马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?立即注册

x
间变性淋巴瘤激酶(ALK)融合基因在非小细胞肺癌(NSCLC)中阳性率为3%~5%。根据艾乐替尼(alectinib)对比克唑替尼(crizotinib)一线治疗ALK 阳性NSCLC的两项Ⅲ期临床研究(J-ALEX和ALEX)结果,指南优先推荐艾乐替尼作为 ALK 阳性肺癌的一线治疗。另外,第三代ALK抑制剂洛拉替尼(lorlatinib)已被证明对第一代或第二代ALK抑制剂获得性耐药的患者有效。
目前,对第一/二代ALK抑制剂的耐药机制已经有了一些发现,如ALK继发性突变、ALK基因扩增和旁路信号激活(包括KRAS突变、EGFR突变、KIT扩增和EGFR 磷酸化水平升高)。然而,对洛拉替尼获得性耐药机制的报道很少。
最近,日本学者报告了一例ALK阳性肺腺癌患者,在脑转移治疗期间对洛拉替尼产生了获得性耐药,组织学转化为鳞状细胞癌(简称鳞癌)伴MET扩增。同时,研究者对以往ALK抑制剂耐药机制的文献进行了汇总分析。 病例报告
患者,58岁,女性,无吸烟史。2011年诊断为肺腺癌T1aN3M0 ⅢB期(图1(a),(b))。
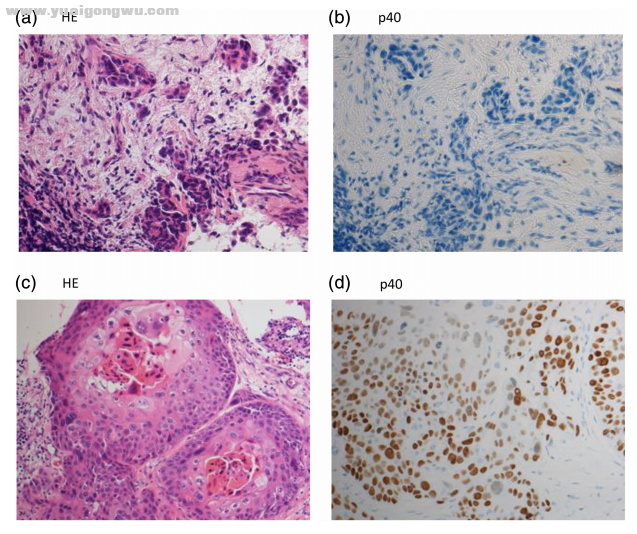
图1. 患者的病理学检查结果(a、b)HE 染色显示腺癌组织学表现,p40阴性表达;(c,d)洛拉替尼耐药后的脑转移瘤样本转化为 p40阳性表达的鳞癌
随后患者接受了同步放化疗(顺铂加长春瑞滨,胸部放疗 60Gy,分30次完成)。3个周期后计算机断层扫描(CT)显示部分缓解。然而,CT发现1级放射性肺炎,于是停止了进一步巩固化疗。CT动态监测肺癌病灶和放射性肺炎变化,未采取任何治疗。
4个月后,CT显示放射性肺炎有所改善,但出现疾病进展。继而接受培美曲塞13个周期,多西他赛5个周期和吉西他滨6个周期。因磁共振成像(MRI)发现脑部多发转移,给予伽玛刀放疗。
转机出现了。2012年,日本批准和开展了ALK重排试验。通过荧光原位杂交(FISH)检查,患者的肺癌标本发现ALK重排,随后接受克唑替尼作为五线治疗 21个月。
由于胸部病灶和脑转移进展,患者接受艾乐替尼治疗 27个月,色瑞替尼治疗3个月,培美曲塞联合贝伐珠单抗3个周期,伽玛刀治疗7次。
由于脑转移进展(图2(a)),患者接受洛拉替尼作为九线治疗。开始治疗的4个月内,脑转移得到控制(图 2(b))。期间,由于出现3级水肿和2级周围感觉神经病变,需要减低剂量和暂时停药。
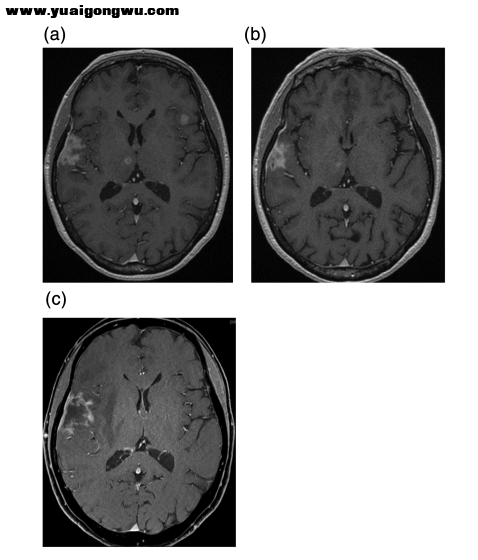
图2. 脑部MRI T1增强扫描 (a)局部放疗后发现多发脑转移;(b)洛拉替尼治疗后,脑转移控制 4 个月;(c)洛拉替尼治疗 6 个月后,右颞叶病灶增大,伴有严重的脑实质水肿
因MRI显示右颞叶转移灶增大,伴有严重的脑实质水肿(图 2(c)),为了缓解症状,切除了肿瘤,患者偏瘫得到了改善。治疗经过见图 3。
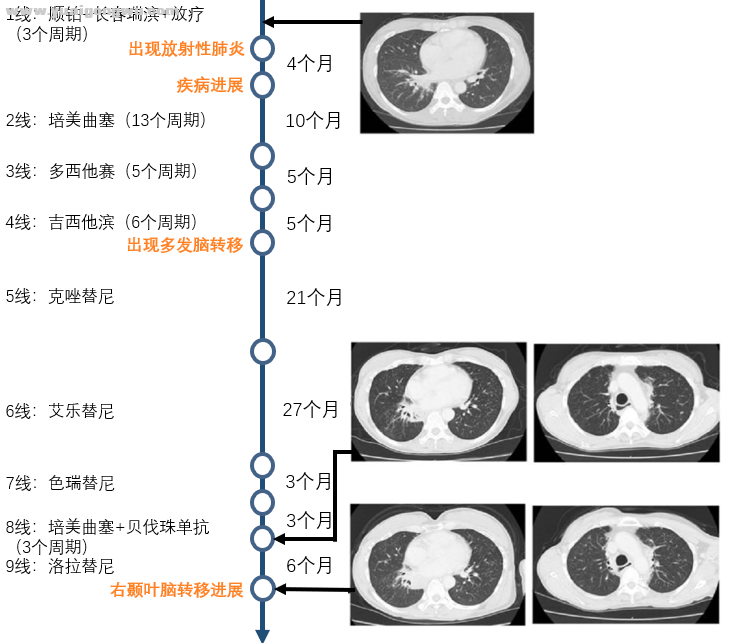
图 3. 治疗经过总结。洛拉替尼治疗6个月后,脑部MRI显示右颞叶转移灶进展,胸腹部 CT 仍显示稳定
组织病理检查显示,患者脑转移组织样本中的癌细胞由腺癌转化为鳞癌(图 1(c),(d))。采用 Oncomine Dx Target Test(赛默飞世尔科技)进行包含 46 个癌基因的二代测序(NGS) ,未发现 ALK 或其他致癌基因的二次突变。
用FISH方法分别评估标本在确诊时和洛拉替尼耐药后的MET扩增情况(图 4(a),(b))。结果显示,在确诊时的样本中,部分细胞观察到MET扩增,但在洛拉替尼耐药后的样本中MET扩增明显增加。
患者在切除脑部肿瘤后恢复洛拉替尼治疗,直到 MRI 证实中枢神经系统发生进展。
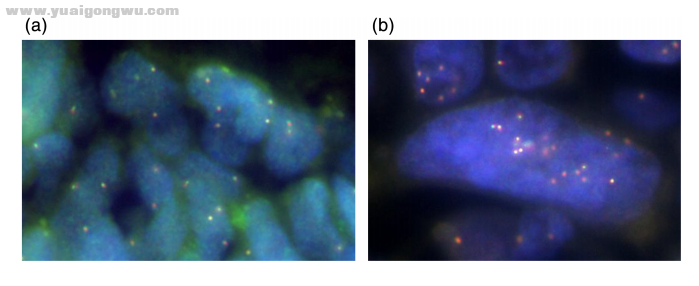
图 4. (a)在确诊时,用FISH方法评估肺活检样本中的MET扩增;(b)洛拉替尼耐药后的脑转移样本。确诊时的部分细胞中观察到MET扩增,但在洛拉替尼耐药后,MET扩增明显增加 讨论
在ALK抑制剂的耐药机制中,ALK继发性突变是主要原因,在克唑替尼耐药的肿瘤中占20%~35%。其次,ALK基因扩增,在克唑替尼耐药肿瘤中占 8.3%。此外,还发现旁路信号激活如 KRAS 突变、EGFR 突变、KIT扩增和EGFR磷酸化水平升高。研究显示,在第二代ALK抑制剂耐药的肿瘤中发现的 ALK继发性耐药突变比第一代抑制剂耐药的肿瘤中更频繁。
近年来有两项研究报道了洛拉替尼的耐药机制。一项研究报道了5例ALK阳性肺癌患者,其中2例发现类似上皮间质转化(EMT)介导的耐药,2例发现ALK复合突变介导的耐药,1例发现NF2双等位基因的功能缺失。
另一项研究显示,在第二代ALK抑制剂耐药后,52份组织样本中6例(12%)有 MET 扩增,而在洛拉替尼耐药后,23份组织样本中5例(22%)有MET 扩增。此外,两份组织样本中存在相同的 ST7-MET重排,其中一例伴有MET扩增。表明,MET扩增是第二/三代ALK抑制剂耐药的重要机制。而采用 ALK/MET抑制剂的联合用药可以使得ALK抑制剂耐药的ST7-MET和MET扩增患者的肿瘤细胞恢复敏感性。
ALK抑制剂另外一个重要的耐药机制是组织学转化。几项研究报道,第一/二代ALK抑制剂耐药后发生了组织学转化,其中大多数是腺癌转化为小细胞肺癌。从腺癌转化为鳞状细胞肺癌的报道仅见于一例克唑替尼耐药和另一例艾乐替尼耐药后。
研究者对接受EGFR抑制剂治疗后发生鳞癌转化的 17例EGFR突变型腺癌患者进行了汇总分析。
结果显示,女性为主(82%),41%的人曾经吸烟,目前均不吸烟。发生鳞癌转化的中位时间是11.5个月。所有病例均维持基线EGFR突变特征,11例(65%)出现第20外显子获得性耐药突变,有8例(47%)出现T790M。在鳞癌诊断后的中位生存期为 3.5个月。
本文中ALK阳性案例,女性、无吸烟史,进展后基线 ALK重排没有变化,除了鳞癌转化外,还发现MET 扩增。Junko Watanabe等报道,与ALK阳性肺腺癌患者相比,克唑替尼在ALK阳性肺鳞癌患者的无进展生存期显著缩短。孟弃逸等汇总了20例接受ALK抑制剂治疗的ALK阳性肺鳞癌患者,中位治疗持续时间为 6.4±4.4个月,比克唑替尼在ALK阳性肺腺癌的临床试验数据(PROFILE1007:7.7个月,PROFILE1014:10.9个月)缩短。以上证据表明,鳞状细胞组织学可能与ALK抑制剂的耐药性有关。
ALK抑制剂,特别是洛拉替尼的耐药机制可能是多重和复杂的。该病例也强调ALK阳性患者在病情进展后重新进行组织检查和多种方法检测(包括FISH等)的重要性。另外,该例在洛拉替尼治疗后,出现鳞癌转化合并MET扩增,在这种情况下,使用仅抑制一种耐药机制的分子靶向药物可能很难克服耐药性。
发现洛拉替尼的耐药机制变得越来越重要。3期 CROWN研究比较了洛拉替尼和克唑替尼,结论支持洛拉替尼作为ALK阳性NSCLC未来的一线标准治疗方案,有望从源头上减少耐药的发生。将来还需要进一步研究,以克服对ALK抑制剂的耐药性。 研究的局限性
本例中,研究者将洛拉替尼治疗后的肿瘤标本和确诊时的标本进行比较得出结论。虽然出现鳞癌转化合并 MET扩增有可能是洛拉替尼以往的治疗引起的耐药,但是,从患者脑部转移在洛拉替尼治疗之初就获得疗效,并在洛拉替尼的治疗过程中发生进展,因此研究者仍然推测鳞癌转化合并MET扩增可能与洛拉替尼的耐药有关。另外,在临床实践中,由于洛拉替尼常作为二线或多线的治疗手段,因此,比较洛拉替尼耐药前和耐药后的组织样本,实际上是一件非常困难的事情。
|