马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?立即注册

x
本帖最后由 keenman 于 2016-11-2 10:54 编辑
! I0 {. y$ {6 C7 t) D5 O4 C. T" ? Y3 V2 G5 ?. M
作者:翱宇
. O: C6 \" ]4 l4 v来源:癌度
7 y& X: K# M' A4 N. L7 `$ ?& B
( A: T1 x! A9 G; Q$ f; j7 \" r分子检测:肿瘤抗击战的前哨侦察兵 8 U9 F5 `" |) T! F- _* o, L
3 i# k, O3 Y/ R) d( M% G3 M" x& ^9 m
兵欲善其事,必先利其器。对肿瘤这场漫长的战争中,如果把药物比作是武器弹药,那么引导这些炮弹准确攻击而少误伤正常细胞、监控预后复发等等检测技术就可比作是前哨侦察兵了,或者可以形象地比作是“眼睛”,可见分子检测手段的重要性。不夸张地说,抗癌这场战争将不断受益于分子检测技术的进步。这篇帖子,我们来对肿瘤分子检测技术做个梳理,对它们的优缺点也做个评述。首先需要明确的是,没有完美的检测技术,只有针对特定情况和特定目的最合适的检测技术。" U1 K1 J+ V8 \' N0 n/ Z: q) O: c
* C& D, n0 z/ v z i% x5 z) R
概述$ |" E0 s% W2 |* k/ D- D5 N4 E
我们首先从遗传信息的传递法则来看目前的诊断技术,生命科学的中心法则是,DNA用来承载遗传信息,DNA转录成为RNA,RNA再翻译成为蛋白质,我们常见的检测技术,基本上就是检测这三种生物大分子的序列信息、表达水平等。由于RNA非常不稳定,很容易降解,因此目前对RNA进行检测多数在科研阶段,但检测RNA的好处是发现新的融合基因。总之目前主流的检测技术,基因测序是对DNA信息进行测定,免疫组化等是对蛋白质水平进行测定。
% X! |) i: _. V. h8 b
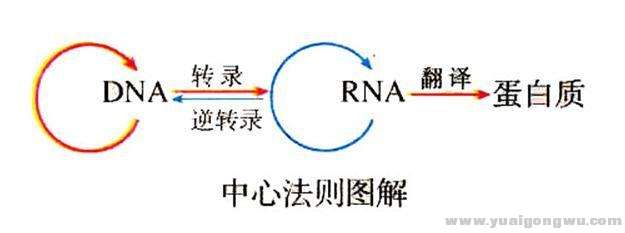
3 i) T; N% ?4 ]7 u& Y4 E, s在上图我们可以看到,虽然DNA转录为RNA,再翻译成蛋白质,但是如果没有DNA水平的扩增,也可能存在蛋白质高表达的情况,具体可能的原因很多,这里只是让大家记住一个结论,如果一个药物是靶向肿瘤细胞的蛋白的,如西妥昔单抗,则最好使用组织样本检测EGFR蛋白水平,而不只是通过DNA水平的EGFR扩增判断是否对药物敏感,DNA水平不扩增,蛋白也可能高表达。+ ~) S: h W4 d4 w, O" ~
' M2 P4 g; S' w. e免疫组化
, _2 U7 Q1 e3 q' s7 [' M( ^% a. S免疫组化,是应用免疫学的原理,使用特异性的抗体检测目标组织样本中某一类型蛋白水平的技术,需要注意的是免疫组化检测的只能是组织样本,如果目标蛋白表达量高可以表现出较为深的颗粒性着色。免疫组化技术已经非常成熟,很多蛋白都有特异的商业化抗体。一般对一个肿瘤进行定性,要检测一系列蛋白的表达情况,根据这些来对肿瘤进行定性。
1 }+ v# |' d# \, N4 @
 # A4 J/ S7 Z; D5 G" E' l2 T
# A4 J/ S7 Z; D5 G" E' l2 T
免疫组化检测组织样本中蛋白表达水平: I3 y* I1 p1 `7 I, S
免疫组化的结果解读有几种解读标准,一般而言如果是3个加号(+)认为是强阳性,如果是一个加号(+)和一个减号(-)也认为是阴性,介于二者之间的两个加号(+)认为是弱阳,如果是弱阳性的情况,有时需要再次使用FISH进行验证。
. K: }8 @! Q9 c- G免疫组化主要检查组织样本的某些蛋白表达水平,主要用于肿瘤的分型。另外也根据一些蛋白表达量,来判断某些靶向药物的疗效。比如检查Her2的表达来指导曲妥珠单抗,检查EGFR表达来指导西妥昔单抗和帕尼单抗的使用、检查MET高表达来看卡博替尼的使用等。一般通过检测某些蛋白表达量高低指导的靶向药物比较少,而且某些蛋白表达水平与靶点药物疗效没有确凿性的关系。如血管内皮生长因子(VEGF)的表达量高低,并不能完全与贝伐单抗的疗效一致。血管内皮生长因子受体(VEGFR)的表达量并不能完全判断靶向药物的疗效。很多时候表达量较低,也是可以使用靶向药物的,如阿西替尼、阿帕替尼等。 , i3 l+ S+ h, K D- [( h
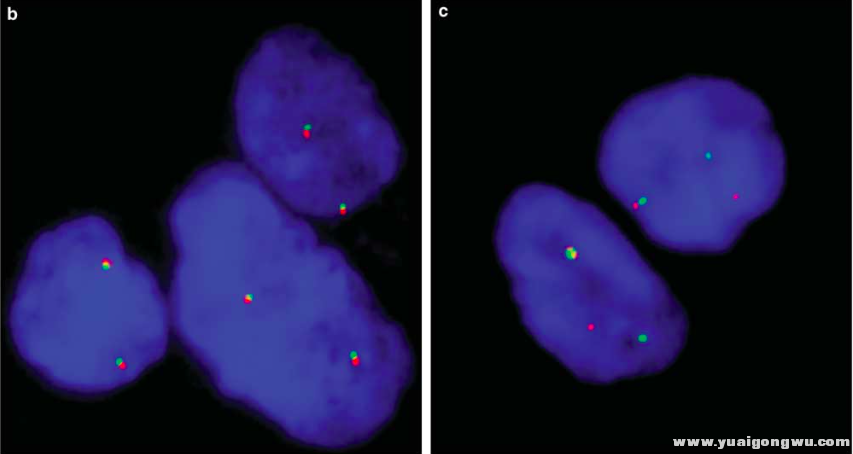
0 K- B0 @0 T( t6 P9 _: W原位免疫荧光杂交FSIH2 t6 _( ?9 [' S' e0 r' i+ f$ _
原位免疫荧光杂交用来判断基因的融合,基因的断裂和重排,另外如存在染色体拷贝数增多也是可以使用FISH的,而且目前而言FISH是一个金标准。
7 o* E! K: V# G0 z( N% u$ O: A3 E
/ d1 d# w$ {' ^$ A6 k! l% J原位免疫荧光杂交技术; P' P+ o4 j- J
FISH的原理是,使用红绿两种荧光探针,分别标记某个基因的两端,如果一个基因的中间没有发生断裂,则红色荧光和绿色荧光靠近,表现的是一种黄色荧光信号,或者红绿两种荧光靠的很近。如果基因发生了断裂,如ALK与EML4基因融合,ALK基因中间断裂,则分别与ALK基因两端结合的红色荧光探针和绿色荧光探针分开,通过计数出现荧光分离的细胞数目,即可判断是否发生了基因断裂。FISH的检测方法比较成熟,但是操作比较复杂,涉及较多的人工,而且检测一个基因或染色体的重排都在3000元左右。不管是ALK基因的融合,还是脑胶质瘤的1p19q染色体重排,操作流程和价格都是类似的。& g; K4 Q) O6 a7 G% h
# Q9 z- g! C) `1 N! X
一代基因测序技术
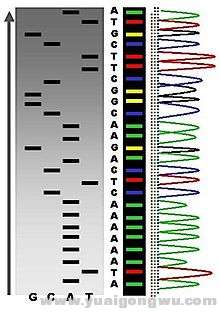
( \" f1 w! {6 m& w3 {一代测序技术出现于上一世纪,是英国科学家sanger发明的,目前仪器和技术比较成熟,特点是一次性可以检测800-1000个碱基的长度,准确度较好,完成一个测序反应的价格在20元左右。但是缺点是通量低,如果是一次性检测几百个基因,几万个基因,这就该使用二代基因检测技术了,尤其是肿瘤具有异质性的特点,需要一次性对肿瘤组织里提取的DNA进行几千次、上万次的测序,对基因突变频率给出相应的数值,这就不是一代检测技术可以完成的了,只能使用二代基因检测技术。但是很多医院里的基因测序仪器都是一代的,主要是仪器价格低,比较成熟和稳定,但是需要知道的是,一代基因检测技术不能检测基因突变频率,而且由于肿瘤存在异质性,所以容易漏检低频的基因突变。' S& H3 H0 I8 i3 Z& o
 3 }$ b: I9 G9 Y' ?: o. } `
3 }$ b: I9 G9 Y' ?: o. } `
一代基因测序技术(Sanger测序法)
) \8 t! Q% `& T4 W/ g/ h( z$ ~5 l1 [3 t C& }- x: a# M9 `3 }0 z; z4 D
二代基因检测技术
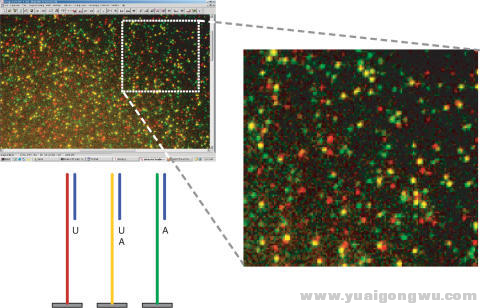
/ Z. G: {2 u' C% j二代基因检测技术也称之为高通量测序技术,主要原理是通过超声波将DNA打成100-200bp的片段,然后通过一定的处理将每一个片段扩增成一个分子簇,再使用相应的技术检测每个分子簇合成一个碱基时释放的荧光信号,或者是电化学信号。可以实现较高的通量,目前较为新的检测技术,可以将人的基因组信息全部测完,价格已经降低为1万元以下。但是需要注意的是,人的全基因组测序是检测人的正常细胞的DNA序列信息,测序深度一般是30-50乘,而且只做基础的简单的分析,不会进行较为复杂的生物信息学分析。由于肿瘤具有异质性的特点,对肿瘤组织检测深度只有几十乘是不够的,有时要测几万乘,而且后面涉及到专业的分析和解读。所以这里有个误区,即为什么测一个人的基因组不到1万,检测几十个基因,几百个基因也得几千元,区别是测序深度和后续的生物信息学分析、报告解读。
$ }4 ]( p7 l8 G
 $ e- H" K. L2 I
$ e- H" K. L2 I
二代基因检测技术的原理! c: s; o9 p4 R0 n3 }7 C
未来一定是二代基因检测技术的天下,当然目前有一个短板是,对血液里肿瘤细胞裂解释放的DNA检测的灵敏度不是很高,原因是血液里肿瘤细胞裂解释放的DNA浓度很低,只占1%左右,大部分是正常细胞裂解释放的DNA,而且二代基因检测技术还有测序深度越高,出现测序错误的问题,这个并不能通过单独加大测序深度来解决。吉因加公司的专利技术可对测序错误进行过滤,数据显示是极大地提高了血液检测肿瘤细胞DNA的灵敏度。9 ~) x% {8 g3 b. `8 t+ T0 J
% s/ H+ x# \3 d, r1 {1 J$ P, h
PCR的祖祖辈辈
( t3 D. v4 U; M( `PCR技术也比较常见地用在肿瘤分子诊断领域。经常容易看到的一些EGFR的突变信息是使用QPCR(荧光定量PCR)检测的。我在研究生期间经常摆弄这种仪器,QPCR的结果是一些扩增曲线,通过设置阴性对照,阳性对照来判断是否存在特定的突变位点。QPCR被称为是第二代PCR技术,第一代PCR是比较传统的PCR扩增技术,这个是获得了诺贝尔奖的一项发明。8 z$ D& u4 ^, B
ARMS-PCR的全称是突变扩增系统,厦门艾德公司具有一些专利,而且还有一些试剂盒获批对相应的突变基因位点进行检测,ARMS-PCR,比传统的PCR技术灵敏度和特异性会高很多,但其也是只能检测有限基因的已知位点。' N, }% r: e% c5 }7 _2 G- E: }+ K) H" w
ddPCR(微滴式数字PCR)是第三代PCR技术,原理是先将模板分子稀释,然后将每一个模板包裹到一个液滴里面(油包水),而且是每个液体只包裹了一个模板DNA分子,通过反应,液滴的DNA分子被放大了百万倍以上。通过对这些液滴进行检测可知道哪些液滴里有DNA模板分子,哪些里是没有的,进而实现绝对的定量。可以做到极为高的灵敏度和准确度,也就是几万个分子里有一个突变的分子DNA,也可以检测出来。这种方法比较适合对血液样本的已知基因突变位点进行检测,如EGFR基因的T790M,ALK基因克唑替尼耐药后出现的守门基因突变等,数字PCR的原理还是PCR,检测的是基因的已知突变位点,但是它极高的灵敏度是特点,比较适合血液样本检测EGFR、ALK的那些二次突变位点,进而知道后续的用药,这里我们也呼吁基因检测公司考虑开发相应的检测产品。
+ Y# B; N6 x# R+ \$ a
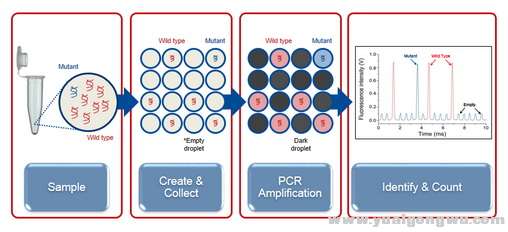 + {' L- ?; v! _, B; m
+ {' L- ?; v! _, B; m
数字PCR的检测原理示意图
9 v: M+ D. j) ]9 L( E, v( e
4 Q8 y Z+ o0 P! q9 [$ c总结* |0 g5 D0 y$ Z0 `9 L+ J+ U: p
如本帖开始所说,没有任何一种检测技术是完美的,也就是既能保证检测的全面,灵敏度又很高,或者未来会有,现在还没有。下图是几种分子检测技术的灵敏度。Sanger(一代测序)的灵敏度是10%,二代基因检测技术的灵敏度是2%,普通数字PCR的灵敏度是1%,ArmsPCR的灵敏度在0.1%,数字PCR的灵敏度可以达到0.01%或者更低。$ H: i* r J' `7 ~; L# N |
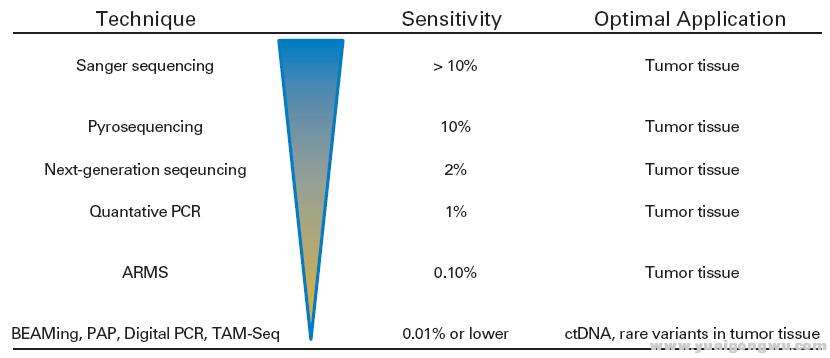
7 y0 J& P1 ?6 s" w# o) c6 ]不同分子检测技术的灵敏度6 e A, `2 ]/ @, [$ W% K4 o
* q$ ^! I; B0 R( l2 m) d5 a
一般而言,如果有组织样本,自然优先使用二代测序,因为癌细胞就在哪里,肯定可以测到突变信息,而且二代测序技术同时测几十个基因,几百个基因价格已经降低为五六千元,基本上是比较平民化的价格了,由于肿瘤的异质性,以及低频基因突变的存在,最重要的是组织样本很珍贵,用了以后再取就得又让患者受苦,所以最好还是测的全面一些,即使用二代基因检测技术。
# ~. E5 i$ P9 z2 F, ?1 v# c对于血液样本,即晚期肿瘤患者,或者不适宜取组织样本的患者。抽血检测肿瘤细胞裂解释放的DNA,这个时候就存在一定的取舍,因为ctDNA的浓度较低,二代检测技术不一定都能测到。但是ARMS-PCR等技术只能检测有限基因的已知位点,而且对于一些基因突变的位置信息还检测不到(如C797S和T790M是顺式的还是反式的?)所以这个需要综合来考虑,即根据患者的治疗过程,选择合适的检测技术,如果就是只想检测EGFR的T790M,或者ALK的守门基因耐药突变,那就是用ARMS-PCR,或者后面的数字PCR,如果根本不知道是什么导致的耐药,甚至什么基因都不清楚,那就使用二代基因测序。
$ r* e, D! v* I2016年召开的肺癌会议上,吴一龙教授宣读了液体活检的专家共识,专家共识的要点如下所示:/ g; e4 G' D" @: ]
1. 检测已知的、单个临床可药物抑制的靶点,液体活检技术推荐ARMS方法;检测已知的、多个平行临床可药物抑制的靶点,液体活检技术推荐NGS(高通量测序)方法。; c& y! H, N6 r& U- T
2. 用于发现未知基因,探索疗效监测、预后判断和发现耐药机制等,液体活检技术建议使用NGS。: f8 S5 M9 M% E, F r
3. 液体活检包括循环肿瘤细胞(CTC)和循环肿瘤DNA(ctDNA)可能用于肺癌早期诊断和复发监测,但目前仅限于科研探索。
: J. A% Z7 j( {0 Q4. NGS用于临床研究,需平衡患者利益、伦理要求和科学发现之间的关系,以患者利益为至上。
4 u" S+ d- {: v: y6 o# a) ]# k/ l9 j7 q9 ?1 {& f
结语. B) X$ E' O0 J4 [
通过上面的文章我们可以了解到,目前来看,二代测序技术已经是主流的肿瘤分子检测技术,但是它在检测血液样本时需要在灵敏度上做些提升。这也并不只是加大测序深度,或者需要在其他方面做些创新,如吉因加公司的这种对测序错误进行的纠错等。目前来看,如果是检测特定基因的明确的位点,对灵敏度要求较高,则还是建议使用ARMS-PCR,以及数字PCR。
2 x4 i" n1 ^. \天下的武器哪一种最好,剑是兵中之王,但是也有缺点,那就是短啊。如果本领不高,遇到个拿长柄大砍刀的也就是悲剧了。或者我们也可以用剑来形容二代检测技术,它是肿瘤分子检测技术里一个威力极大的武器,但是其并不是完美无缺,当然在使用上也需结合患者的治疗状况,检测的目的,与其他检测技术配合。
( l6 G, T1 q6 i7 N9 ]4 |
' d' g0 @0 c/ r+ i, S6 g% p0 X& F0 _( ], ~$ Z+ k
参考文献
" s7 o5 v V4 J1、Diaz and Bardelli. J Clin Oncol, 2014,Feb 20;32(6):579-86.
4 x7 w1 ? Y0 p3 \% K4 z2、Liang Cheng, et al., Modern Pathology (2012) 25, 347–369.- f0 q2 a" T$ L Z# P
1 k7 {8 e" t/ j8 {/ ]
/ ?# d' S' a5 c4 S+ z6 d! x6 a |