马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?立即注册

x
起底泰瑞沙(AZD9291):不可不知的关键临床数据 # I7 {4 `4 | K6 G, x9 n
# Y. ^& |1 b7 G
 5 t( D! z2 I. G7 O2 y+ S
, q! S6 G% N! @1 X# T- \4 t7 h" q
5 t( D! z2 I. G7 O2 y+ S
, q! S6 G% N! @1 X# T- \4 t7 h" q
0 `$ `* f' {! v6 K
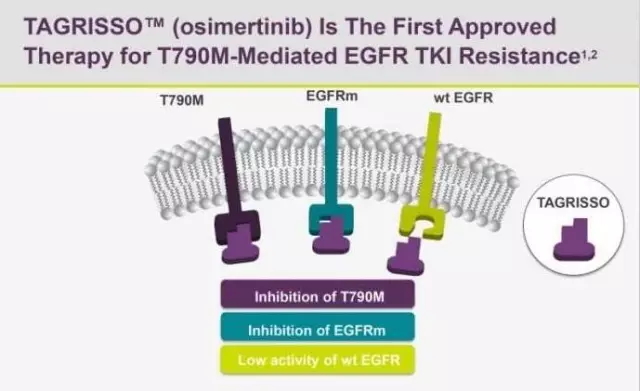
泰瑞沙(AZD9291)精准结合T790M突变点位,不结合野生型EGFR。
3 M) _+ R5 }/ ~, E* ]' |& l9 P9 T5 g
关于非小细胞肺癌. f3 b. d9 I1 M/ g' T
. I) X6 p: ?2 K) B
肺癌已成为人类因癌症死亡的主要原因,肺癌死亡人数约占所有癌症死亡人数的三分之一,超过因乳腺癌、前列腺癌和结肠直肠癌死亡人数总和。肺癌患者中,约25%-40%肺癌患者随着病程发展会发生脑部转移。占欧洲非小细胞肺癌患者10-15%和占亚洲非小细胞肺癌患者30-40%的EGFR突变非小细胞肺癌患者,对现有的表皮生长因子受体(EGFR)酪氨酸激酶抑制剂特别敏感。该抑制剂通过阻断驱动肿瘤细胞生长的细胞信号传递通路来抑制肿瘤。然而,肿瘤几乎总会对药物产生抗药性,导致疾病进展。在接受吉非替尼、厄洛替尼等EGFR酪氨酸激酶抑制剂治疗的患者中,约三分之二患者的耐药由T790M次级突变引起。
# p3 W! q- ?' [3 U0 S( v, e1 N: L* ^8 k
关于泰瑞沙(AZD9291)+ \3 Y( J0 `) @' U2 x2 a- r5 P _
# a+ B R. h6 G
泰瑞沙(甲磺酸奥希替尼片, 即患友熟知的AZD9291)是阿斯利康公司研发的第三代口服、不可逆的选择性EGFR突变抑制剂,是全球第一个上市,也是中国首个获批的用于EGFR T790M突变阳性的局部晚期或转移性非小细胞肺癌的肿瘤药物。
$ z% z" a/ W1 o; P5 q* d4 d# n; |, N
该药从临床试验到通过FDA批准上市仅用时两年半,是阿斯利康史上最快的研发项目之一。该药是一种不可逆的选择性EGFR突变抑制剂,它源自科学家对肿瘤耐药机制的深入探索,能对由于T790M突变引起的肿瘤耐药产生精准抑制。目前,阿斯利康正在研究泰瑞沙作为辅助治疗及一线治疗脑转移或未发生脑转移的非小细胞肺癌(NSCLC)患者、肺癌软脑膜转移患者以及泰瑞沙与其他药物组合的疗效。
& D8 b. E) _& g8 J& b: U* ~! T" \- |) q
泰瑞沙80mg片已在美国、欧盟、日本、加拿大、瑞典、以色列、墨西哥、澳大利亚等多个国家和地区批准用于EGFR T790M突变阳性的局部晚期或转移性非小细胞性肺癌(NSCLC)患者的首个治疗药物。韩国也批准了泰瑞沙的相同适应症。经基因检测确认存在EGFR T790M突变患者可使用泰瑞沙进行治疗。8 [2 g4 L- i- I' t
* |7 m5 M) `* E* x& E$ v2 V9 A关键临床数据
+ ]6 d4 W) [5 q- i Q
$ n& a/ ^+ [9 _6 ]& v已进行的几项关键临床研究显示,泰瑞沙对于T790M 突变而产生耐药的非小细胞肺癌患者,能显著减缓或阻止病情进展,或缩小已有的肿瘤。: U+ P- C) Z; D& G, _
s% E4 {$ d! J6 I
AURA3 III期临床研究
, T7 @5 l& |+ K& C* M; v- {& a7 T( q- L" r% S! J" ~& X
● 第一个精确选择了一线EGFR-TKI治疗耐药后,二线T790M突变阳性患者,与化疗头对头的三期国际多中心临床研究,共纳入419例患者,其中48例中国患者。( \# i! V1 V. q/ z5 ~ x2 K% d% @/ D
0 {! y0 {) z% D- H& i
● 该研究进一步验证了AURA2等单臂研究中泰瑞沙的疗效。作为一个非小细胞肺癌的二线临床研究,第一次显示出超过10个月的PFS(研究着评估PFS10.1个月,BRIC评估11个月),与培美联合铂类的化疗相比,疾病进展风险下降70%(HR:0.30),而以往的化疗取得的PFS只有4-5个月。
i/ e1 u3 r# Z6 q2 y
) a) [% h8 r& y; e* r1 J- p+ y* vAURA17 II期临床研究/ n9 h$ g4 W5 k4 j; q q, A0 A
/ ~5 O0 x! K- ~. j● 一项开放性、单臂II 期研究,共纳入171例患者,其中148名中国患者,旨在东亚人群中,评估泰瑞沙用于既往EGFR-TKI进展或化疗进展后的EGFR T790M患者的疗效和安全性。
3 B6 u6 ?% K% a0 u! x# R, v. H5 v5 J, Q4 d! j( d; ]8 D2 x
●BICR确认的ORR和DCR分别为60%(95%CI,52-68)和88%(82-92)。中位DoR和PFS还未成熟。
1 I" d6 ~+ v6 e0 _" g$ h% Q1 t: I6 k
● 这一数据与既往全球II期研究结果相似,证实了泰瑞沙在东亚人群的疗效。泰瑞沙的耐受性好,≥3度的AE发生率很低,AE及其发生率与既往全球研究结果相似,未发现新的AE。% | o" `/ e2 R) _$ e* B- Q
2 \7 l) r. v/ A2 f1 c8 i
AURA3 III期临床研究
, c: Q+ M3 N. D
: t# }% q7 p# M6 v7 e● 一项开放性、两阶段I期研究,旨在评估泰瑞沙在既往接受EGFR-TKI治疗后疾病进展的中国晚期非小细胞肺癌患者中的安全性、耐受性、药代动力学和初步抗肿瘤活性。 共入组31位中国患者。5 g6 B! V" Q+ w7 f8 y: ^
9 q$ T3 z6 E3 V● 初步结果显示泰瑞沙对中国人的药代和全球一致,推荐80mg每日一次给药。显示出非常好的临床疗效和安全耐受性。 U: p( f" D( K; M8 s" w
' \" G. ?( k2 t7 }
8 s p' E* E+ g/ G6 B: r
 4 S, D* n" {* H) L8 v
4 S, D* n" {* H) L8 v

& I5 ]" @) x1 y" ^ h: f5 O
|
|
|
|
|
|
|
共1条精彩回复,最后回复于 2019-3-1 18:45

累计签到:858 天
连续签到:33 天
[LV.10]至尊爱粉