马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?立即注册

x
 5 N; g8 b- } j% D$ \" q" e4 n
5 N; g8 b- } j% D$ \" q" e4 n
s$ _) }# M0 G7 [0 p5 o3 {
目录 5 h- h; @' U- j& h k9 x& r
- a" N4 j$ K0 i$ s$ \
 3 R5 f8 V2 t' y' ]$ p7 Q
3 R5 f8 V2 t' y' ]$ p7 Q
; c$ V' \( g- f8 ^ @非浸润性乳腺癌
$ q4 ~/ ]( e% T, r6 p |
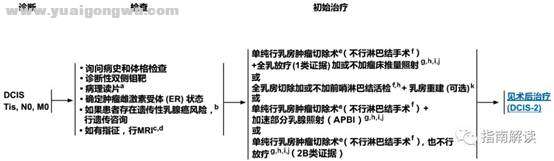
. ~; t0 p0 X" N导管内原位癌的检查和初始治疗(DCIS-1)8 w! J. q; w( G
. N1 o/ ]- G+ H
 , V2 X5 Q" Q* f6 X* @+ G
, V2 X5 Q" Q* f6 X* @+ G
$ g" D2 b( k5 f j/ D脚注:8 z1 w6 s/ o8 F; q; y! V4 m' `6 W( `
a.指南专家组支持所有浸润性和非浸润性乳腺癌的病理报告都遵循美国病理学家协会颁布的草案。http://www.cap.org。
; |5 P* ?' J7 G$ Fb.见“NCCN遗传/家族性高风险评估指南:乳腺癌和卵巢癌”。
/ M; L& v' U. @3 R; e6 g; zc.见“乳腺专用MRI检查原则”(BINV-B)。! O8 P7 T$ }: [+ j
d.进行MRI检查并未显示可以提高阴性切缘率或降低转为全乳切除的几率。缺乏支持可以改善长期预后的数据。' C% k K8 v+ Y9 o1 ]* n7 T
e.渴望接受保乳治疗的患者,可能需要再次切除以期获得阴性切缘。乳房肿瘤切除术不能获得足够的手术边距(安全边距)时应行全乳切除。关于手术安全边距的定义,见“导管原位癌和浸润性乳腺癌切缘状况的建议”(BINV-F)。. E0 _/ F; C; v8 d$ m4 }/ x
f.对于貌似单纯性导管内原位癌的女性患者,在没有浸润性乳腺癌证据或者未证实存在腋窝转移时,不应当进行全腋窝淋巴结清扫。然而,一小部分貌似单纯性导管原位癌的患者,在她们接受根治性手术的时候可能发现存在浸润癌。因此,如果貌似单纯性导管原位癌的患者准备行全乳切除术或受累的解剖部位切除,强烈推荐在切除术时行前哨淋巴结活检,否则由于解剖结构已经受到影响,以后恐怕难于再行前哨淋巴结活检。8 }" G7 U$ K5 U3 @
g.见“放疗原则”(BINV-I)。4 z5 w" P* T( H% s
h.在全乳切除或再次切除时发现有浸润性病变的患者,应视为临床I期或II期肿瘤进行处理(包括淋巴结分期)。
- r# t3 U% z) T: s4 D- wi.见“需要行放疗的保乳手术患者的特别注意事项”(BINV-G)。
/ t, K. b! ~& N3 P" sj.导管原位癌患者在乳房肿瘤切除后行全乳放疗可以降低约50%的复发率。复发的患者中大约有一半是浸润性乳腺癌,一半是导管原位癌。许多因素决定局部复发的风险:可触及的肿块、瘤体较大、较高级别、切缘距肿瘤近或切缘阳性、和年龄<50岁。如果患者和医生都认为个体复发风险“低”,一些患者可仅接受手术切除治疗。一些选择性的低风险DCIS患者,如果他们符合RTOG 9804试验中关于低风险DCIS定义的所有条件(包括筛查发现的DCIS、低-中等核分级、肿瘤大小≤2.5 cm、手术切缘阴性且距离肿瘤的边距>3 mm),可以考虑接受APBI。; Y/ p- p" @+ H6 ^: l
k.见“术后乳房重建原则”(BINV-H)。
! M) ^ R. d4 J: X: Q' |" H________________________________________# v; C( s! p$ N5 `( s3 h% @5 T6 R
3 c$ _/ K0 p& \( {0 W' @% Z
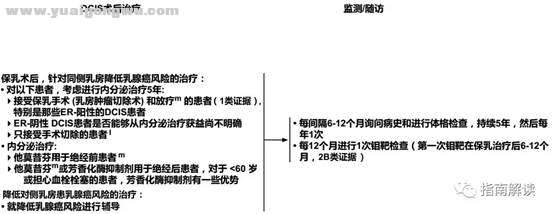
导管内原位癌的术后治疗和监测/随访(DCIS-2)
! v( B; V" J( v
: d/ }. z) ]- J: |( ]1 s
 0 g, v( t% M L |0 f
0 g, v( t% M L |0 f
6 o0 l+ M9 P! n6 v0 c脚注:
5 Y0 z' `- }* A! `l.现有资料表明内分泌治疗可降低接受保乳治疗的患者同侧乳房患乳腺癌的风险,以及接受全乳切除或保乳手术伴原发肿瘤ER阳性的患者对侧乳房患乳腺癌的风险。由于目前并没有显示出生存期的优势,因此个体化评估风险/获益很重要(也见于《NCCN乳腺癌降低风险指南》)。: L9 @. E+ M6 f" m/ a1 u
m.对于考虑接受他莫昔芬治疗的女性患者,不推荐进行CYP2D6基因型检测。
. R$ m4 a0 |! I; l) m________________________________________
+ }: [& w8 T* i3 j; y! ~ 1 g$ Z, P' f) x) R
浸润性乳腺癌 6 P+ ?% B/ ]& e
" b+ `: U: V9 c. y3 z6 [临床分期,检查(BINV-1)0 D- x4 J# w: r
/ k, N6 L) Y7 v8 a( S4 q r: K) q
 7 F8 f6 e$ J' h6 f% `: F1 j
7 F8 f6 e$ J' h6 f% `: F1 j
: J0 ?4 F8 B& X, L* f% r0 c! G
脚注:5 Y5 k- n. x; s+ ]3 K
a.关于帮助老年肿瘤患者进行最佳评估和管理的工具,参见《NCCN老年人肿瘤指南》。
2 q- m; J& J4 l- @! m0 e5 ~- zb.乳腺MRI可能有助于表征腋窝和/或内乳淋巴结转移性疾病。参见乳腺专用MRI检查原则(BINV-B)。# l7 u `9 Z8 h k9 x: S1 T
c.指南专家组支持所有浸润性和非浸润性乳腺癌的病理报告都遵循美国病理学家协会颁布的草案。http://www.cap.org。+ R5 B/ v8 P2 b4 d9 u
d.见“生物标志物检测原则(BINV-A)”。1 O' t, A$ P" v8 o3 w8 X
e.关于风险定义的标准,参见《NCCN遗传/家族性高风险评估指南:乳腺和卵巢》。' O& {8 [: `% a; w
f.见“生育能力和节育问题(BINV-C)”。
3 b6 z2 H- D3 k+ i. Rg.见《NCCN心理痛苦管理指南》。9 s8 k: `7 _) Y9 A
h.对于没有症状的早期乳腺癌,不推荐常规行全身分期。
: C" o1 }! s9 j6 W! `9 I1 ^$ Z; Ii.如果进行了FDG PET/CT检查并在PET和CT部分均清楚地指示骨转移,则有可能不需要再行骨扫描或氟化钠PET/CT。3 d5 y3 w! U* H7 y& k5 o% S5 f
j.FDG PET/CT可在行诊断性CT检查的同时进行。临床I、II期或可手术的III期乳腺癌的分期并没有指征行PET或PET/CT扫描。FDG PET/CT最有助于标准分期检查难以判断或者存在疑问时的协助诊断(特别是对于局部晚期或转移性乳腺癌患者)。
0 y* s$ e- k( B0 E3 Rk.FDG PET/CT联合常规的分期检查方法,有可能检测出局部晚期乳腺癌病例中未被怀疑的区域淋巴结转移和/或远处转移。) v& j8 ^. I3 ^1 R/ n1 x% ?- J
________________________________________3 C2 c! J$ s( Q: J# ^
- t( S5 z8 o) T' U4 A
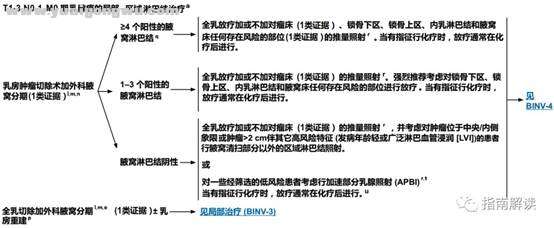
T1-3,N0-1,M0期乳腺癌的局部-区域淋巴结治疗(BINV-2,3)
6 J, X% o" A! m( a3 Q: J0 k
" u5 o4 d- U% `- G/ C8 h3 rBINV-2
$ T* ^$ C/ P& a9 ?( b* x3 e# _2 ?, O: o6 l; b: F6 A( j
 3 m4 `, i- ]6 K. H
3 m4 `, i- ]6 K. H
0 U" |& c3 I# c( ?
脚注:1 X% l& ~( h, v3 `. p8 Q, m# T
a.关于帮助老年肿瘤患者进行最佳评估和管理的工具,参见《NCCN老年人肿瘤指南》。1 Z7 y9 }8 S# F3 A, s0 }
l.见“外科腋窝分期(BINV-D)”。$ X8 R# g$ f" M$ m4 u5 e
m.见“腋窝淋巴结分期(BINV-E)”和“DCIS和浸润性乳腺癌的切缘建议(BINV-F)”。
: ^9 }3 C: Y0 E3 V# Z- F& yn.见“需要接受放疗的保乳治疗的特别注意事项(BINV-G)”。. b* C( \' }( w# V* _7 C1 i' o
o.除非属于《NCCN遗传/家族性高风险评估指南:乳腺和卵巢》以及《NCCN乳腺癌降低风险指南》中列出的对象,对于已知患单侧乳腺癌的患者不推荐进行对侧乳腺的预防性切除。当考虑进行此手术时,必须权衡对侧乳腺预防性切除术对于单侧乳腺癌患者所能够带来的小获益与患侧乳腺癌出现肿瘤复发的风险、双侧乳腺切除术所带来的精神心理和社会问题、以及进行对侧乳腺切除术所伴随的手术风险。强烈反对对接受保乳手术的患者进行预防性对侧乳腺切除术。; Q6 l% X6 W# u% Q5 G+ G1 U/ A
p.见“术后乳房重建原则(BINV-H)”。
: r( w( ?+ A3 U4 ]6 Xq.考虑行影像学检查来进行全身分期,包括胸/腹部±盆腔诊断性CT平扫加增强扫描、骨扫描和可选择的FDG PET/CT(见BINV-1)。+ d9 b% p: K( j6 J0 `* J) R
r.见“放疗原则(BINV-I)”。' o: G& |4 v+ h
s.对于符合ACOSOG Z0011标准的患者,考虑采用切线野/高切线野。* C N4 {+ ~; c
t.PBI可在化疗前进行。5 w' z6 }& M+ t5 U, e6 Y3 i' Z- D+ ~
u.对于年龄≥70岁的ER阳性,临床淋巴结阴性,接受辅助内分泌治疗的T1期肿瘤患者,可免予行乳房放疗(1类证据)。
! F- u2 L4 p" ~' d# [, o
& J; _7 m: P3 {3 L0 q' J% x dBINV-3
6 d/ l$ V* J: }0 X& f1 s. A1 i( S1 Z" Y$ H
 6 e" I6 _4 R+ Y) D' U3 G0 B+ Q
6 e" I6 _4 R+ Y) D' U3 G0 B+ Q
# p) c4 V* s, G6 f9 i) \脚注:
! o; t! G [6 u! W1 S& ka.关于帮助老年肿瘤患者进行最佳评估和管理的工具,参见《NCCN老年人肿瘤指南》。. X! j8 s6 |3 ]! {0 L
l.见“外科腋窝分期(BINV-D)”。
, w2 D& [+ Q; T6 G! }6 [m.见“腋窝淋巴结分期(BINV-E)”和“DCIS和浸润性乳腺癌的切缘建议(BINV-F)”。
6 y9 j3 {1 E+ _p.见“术后乳房重建原则(BINV-H)”。
7 g1 ~. n4 |2 o" v5 o3 ?q.考虑行影像学检查来进行全身分期,包括胸/腹部±盆腔诊断性CT平扫加增强扫描、骨扫描和可选择的FDG PET/CT(见BINV-1)。 t6 N; B! }) y, q* W7 Z
r.见“放疗原则(BINV-I)”。
& O0 x( Z0 |* F9 S( c" Pv.见男性乳腺癌的特别注意事项(BINV-J)。; f* o' [' ]5 N2 [' U+ j
w.对于未行腋窝淋巴结清扫的微转移(> 0.2至≤2.0mm)病例,当考虑进行放疗时,请评估其它的患者相关危险因素。2 E) u% g/ T) g( }' a4 B
x.存在多个高危复发因素(包括肿瘤位于中央/内侧或肿瘤>2cm伴其它高危特征[如发病年龄轻和/或广泛淋巴血管浸润])的患者在乳房切除术后,可考虑行术后放疗。
{# s6 f# U f/ e% F+ L________________________________________' j( t& `0 Y- h [. e! B6 X" G
- C; C% S! g" ~' c- @
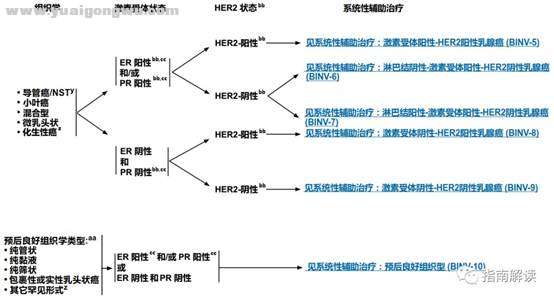
系统性辅助治疗(BINV 4~10)
8 t B7 y2 a# ^7 k, e+ w
0 ^2 M& }- n% m0 \: rBINV-4% L) s d, `, H
基于受体状态和Her-2状态行全身辅助治疗
* m9 _4 B/ Q" t {+ S# a
/ r7 }# X3 j& c, J& x
 " ~# i7 _9 V6 ^& z/ [* o9 T! j
" ~# i7 _9 V6 ^& z/ [* o9 T! j
- R6 N6 h( k# v
脚注:
; P- C! V! R! r: F+ i- B+ I) Wy.根据世界卫生组织的定义,非特殊型癌(NST)涵盖多种模式,包括髓样模式、具有神经内分泌表达的癌症和其它罕见模式。
. w: f2 S, @9 P3 Z$ ]3 `zz.有一些罕见的化生性癌亚型(如低级别腺鳞癌和低级别纤维瘤样癌),被认为在不接受辅助全身治疗的情况下预后良好。
" I- b* M* B; V* e3 u( o ]aa.良好的组织学类型与良好预后相关,但应是纯的(在手术切除标本上[不是单纯的芯针活检标本]良好组织学类型的比例> 90%),不含高级别癌且HER2阴性。如果存在非典型的病理或临床特征,请考虑按导管癌/NST治疗(请参阅BINV-4)。* }% {/ R* K, P2 s
bb.组织学、激素受体和HER2状态的相关性应始终在了解异常/不一致或临界结果的情况下进行。参见生物标志物检测原则(BINV-A)。! b$ e* ~; K' r/ K- H
cc.尽管IHC法检测ER,染色1%-100%的癌症患者被认为是ER阳性且适合接受内分泌治疗,但关于ER弱阳性(1%-10%)亚组癌症患者的数据有限 。ER弱阳性组存在异质性,据报道其生物学行为通常类似于ER阴性的癌症。在作其它辅助治疗和总体治疗路径的决策中应考虑到这一点。参见生物标志物检测原则(BINV-A)。0 V3 S+ a' F! _% I
g2 P) ^2 ^# Q
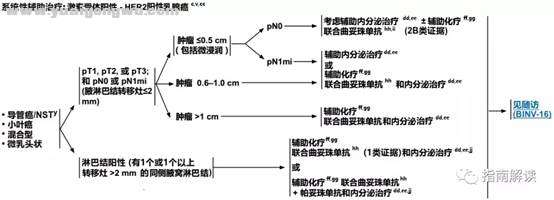
BINV-5, o5 V! l, [% s2 z, e) N" o
激素受体阳性,HER2阳性乳腺癌1 J/ M9 B+ s: |! r
9 R! M: |6 g3 H6 \2 o6 c* U' I
 : }. ~# l$ i& z. v9 J3 A
: }. ~# l$ i& z. v9 J3 A
% i }) D& D3 j- R脚注:
+ k3 X$ n5 F# k( d1 _3 cc.见生物标志物检测原则(BINV-A)。' I" } X! r. C
v.见男性乳腺癌的特别注意事项(BINV-J)。) T. o8 W# |2 l6 M5 h
y.根据世界卫生组织的定义,非特殊型癌(NST)涵盖多种模式,包括髓样模式、; u3 O5 s( `. z6 i9 |1 f
cc.尽管IHC法检测ER,染色1%-100%的癌症患者被认为是ER阳性且适合接受内分泌治疗,但关于ER弱阳性(1%-10%)亚组癌症患者的数据有限 。ER弱阳性组存在异质性,据报道其生物学行为通常类似于ER阴性的癌症。在作其它辅助治疗和总体治疗路径的决策中应考虑到这一点。参见生物标志物检测原则(BINV-A)。
$ U! _& g+ N0 Idd.对于接受辅助治疗的绝经后(自然或诱发)患者,考虑予双膦酸盐辅助治疗。
' _9 I; {8 S3 I; e0 _0 e! X! Q9 o" gee.证据支持激素受体阳性的绝经前女性乳腺癌患者从卵巢手术或放疗去势的获益程度与单用CMF相似。见“辅助内分泌治疗(BINV-K)”。
1 f8 L2 V# I( P& ?/ [ff.采用化疗和内分泌治疗联合方案行辅助治疗时应按照先化疗后内分泌治疗的顺序进行。现有数据表明,内分泌治疗加序贯或同步放疗是可以接受的。见“辅助内分泌治疗(BINV-K)”和“术前/辅助治疗方案(BINV-L)”。7 z1 n9 T# H H9 o; M7 ~, {, [
gg.支持70岁以上的患者接受化疗的数据有限。见《NCCN老年人肿瘤临床实践指南》。
/ Q% l5 x3 @( e: y+ c3 k0 ~hh.T1a和T1b期,淋巴结阴性的患者即使HER2扩增或过表达,其预后也不确定。目前尚没有研究该类人群的随机试验。该组患者是否使用曲妥珠单抗治疗必须权衡已知的曲妥珠单抗毒性(例如心脏毒性)和不确定的绝对获益后进行决策。8 o F1 e6 ~2 a# G! H2 g* }! D, d% c
ii.每周一次紫杉醇联合曲妥珠单抗的辅助化疗方案(Tolaney et al.NEJM 2015) 可考虑用于T1NOM0期,HER-2阳性的乳腺癌患者(特别是原发肿瘤激素受体阴性)。对于肿瘤大小接近T1mic(<1mm)的激素受体阳性乳腺癌患者,当预期复发风险低于5%而内分泌治疗可作为全身治疗的一个可行选择时,基于HER-2的全身治疗的绝对获益可能可以忽略不计。
; `. M: r' e# o- s1 r3 H4 T' ljj.对于HR阳性,HER-2阳性并且认为有高复发风险的乳腺癌患者,在接受含曲妥珠单抗方案的辅助治疗后,可考虑予来那替尼(neratinib)延长辅助治疗。对曾接受过帕妥珠单抗治疗的患者,接受来那替尼延长辅助治疗的益处或毒性尚不清楚。
) \, Z% H6 X/ a9 [4 z& q ' A8 q' \4 v4 {; C$ H
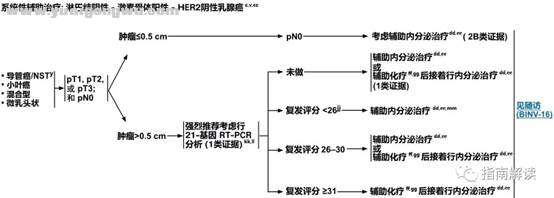
BINV-6: o( i' e7 H* I1 M2 h7 t; ?' b
淋巴结阴性,激素受体阳性,HER2阴性乳腺癌; f" z* |0 R N |
1 [7 R: Z) o* z
 8 P1 i; W% F2 t2 [0 U6 s
8 P1 i; W% F2 t2 [0 U6 s 4 L8 W3 B: h5 b; p
脚注:: \7 }1 Y6 c7 ]" i
c.见生物标志物检测原则(BINV-A)。
- @; ~: }, R) C! B9 H3 lv.见男性乳腺癌的特别注意事项(BINV-J)。
/ U/ ]3 I J6 W% X1 G$ `y.根据世界卫生组织的定义,非特殊型癌(NST)涵盖多种模式,包括髓样模式、
& q. Q2 z, S# G% {$ }cc.尽管IHC法检测ER,染色1%-100%的癌症患者被认为是ER阳性且适合接受内分泌治疗,但关于ER弱阳性(1%-10%)亚组癌症患者的数据有限 。ER弱阳性组存在异质性,据报道其生物学行为通常类似于ER阴性的癌症。在作其它辅助治疗和总体治疗路径的决策中应考虑到这一点。参见生物标志物检测原则(BINV-A)。* {. v- W N; ?+ L) p1 j# S
dd.对于接受辅助治疗的绝经后(自然或诱发)患者,考虑予双膦酸盐辅助治疗。
) k, `! ?, p* `% _# ?8 d4 g4 q6 `ee.证据支持激素受体阳性的绝经前女性乳腺癌患者从卵巢手术或放疗去势的获益程度与单用CMF相似。见“辅助内分泌治疗(BINV-K)”。
- C7 @! |9 v$ Z2 xff.采用化疗和内分泌治疗联合方案行辅助治疗时应按照先化疗后内分泌治疗的顺序进行。现有数据表明,内分泌治疗加序贯或同步放疗是可以接受的。见“辅助内分泌治疗(BINV-K)”和“术前/辅助治疗方案(BINV-L)”。
5 J& b# ~. ~ c4 v( Fgg.支持70岁以上的患者接受化疗的数据有限。见《NCCN老年人肿瘤临床实践指南》。2 D2 m: M V6 a* R/ a
kk.其它与预后分析相关的基因表达分析可考虑用于辅助评估复发的风险,但对于化疗疗效的预测尚未得到验证。见基因表达分析指导辅助内分泌治疗基础上行辅助全身性化疗的决策(BINV-N)。
* x5 v. ~+ N A1 ]6 rll.组织学为低级别且无淋巴脉管浸润的T1b肿瘤患者应接受单一内分泌治疗,因为TAILORx试验中不包括患有此类肿瘤的患者。
; i. ]) F5 j. s6 f$ rmm.对于复发评分为16-25分的年龄≤50岁的女性患者,来自TAILORx研究的探索性分析显示较年轻的患者接受化疗有潜在获益。参见“讨论”章节。# ^( k8 [% k) c5 j
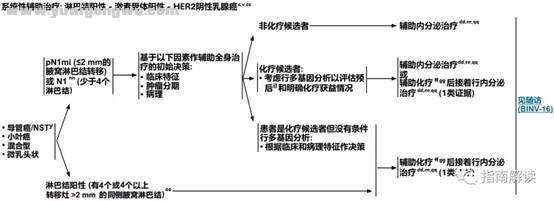
c% j" Q* _7 v DBINV-7
1 a' k" P$ F6 ]' y! F淋巴结阳性,激素受体阳性,HER2阴性乳腺癌
7 K' I' g5 D4 t$ { U2 n4 j- u" F
 ! U+ K4 A) m3 ~# @' M" H
! U+ K4 A) m3 ~# @' M" H
* x3 [/ ^* _4 n- X
脚注:: D2 l" l' C* E9 k! F2 r' A
c.见生物标志物检测原则(BINV-A)。% U/ c6 y; R* ~6 i
v.见男性乳腺癌的特别注意事项(BINV-J)。+ E% ^' O6 f( Q1 L
y.根据世界卫生组织的定义,非特殊型癌(NST)涵盖多种模式,包括髓样模式、' G8 i: Y; O, d0 z- j
cc.尽管IHC法检测ER,染色1%-100%的癌症患者被认为是ER阳性且适合接受内分泌治疗,但关于ER弱阳性(1%-10%)亚组癌症患者的数据有限 。ER弱阳性组存在异质性,据报道其生物学行为通常类似于ER阴性的癌症。在作其它辅助治疗和总体治疗路径的决策中应考虑到这一点。参见生物标志物检测原则(BINV-A)。
4 {8 o8 ~% l) j1 Mdd.对于接受辅助治疗的绝经后(自然或诱发)患者,考虑予双膦酸盐辅助治疗。
6 i4 g; V6 a) l0 w4 h5 |ee.证据支持激素受体阳性的绝经前女性乳腺癌患者从卵巢手术或放疗去势的获益程度与单用CMF相似。见“辅助内分泌治疗(BINV-K)”。
: w4 \) v/ \; ]# z- S! N7 r) pff.采用化疗和内分泌治疗联合方案行辅助治疗时应按照先化疗后内分泌治疗的顺序进行。现有数据表明,内分泌治疗加序贯或同步放疗是可以接受的。见“辅助内分泌治疗(BINV-K)”和“术前/辅助治疗方案(BINV-L)”。
' H) u6 J& U- z2 qgg.支持70岁以上的患者接受化疗的数据有限。见《NCCN老年人肿瘤临床实践指南》。
" _$ F( R y: P6 Fnn.在N1mi和N1患者中,多基因检测用于预后分析,未被证实可以预测化疗是否能够获益,但可用于鉴别低风险人群,当这部分人群接受适当的内分泌治疗时,可能从化疗中获得比较小的绝对益处。关于21基因RT-PCR分析,前瞻性试验的二次分析表明,该检测可预测有1-3个同侧腋窝淋巴结转移的女性患者的化疗获益。尚未证实有其它的多基因测定方法可对化疗的获益作出预测。
% _* E% X+ y, }2 Eoo.关于多基因检测在有≥4个同侧腋窝淋巴结转移的女性患者中的作用,数据很少。该组患者是否进行辅助化疗的决策应基于临床因素。
8 h& G( r, V# F# Fpp.见基因表达分析指导辅助内分泌治疗基础上行辅助全身性化疗的决策(BINV-N)。4 E' Q4 s* E% Y$ E$ ], T& `' R
0 p. o2 C" C6 }; E4 W/ o: B$ y
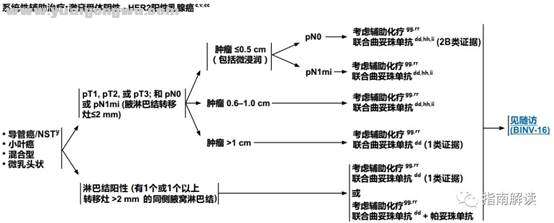
BINV-8
3 o( B5 W% w" M激素受体阴性,HER2阳性乳腺癌1 c1 m! l. i# L/ ~
/ i9 [9 _( s. X
 + k* i, x6 ?9 u4 s3 B
+ k* i, x6 ?9 u4 s3 B
/ L2 e6 M/ w3 r, D. s脚注:' k, g% o, S7 F- I" o8 u
c.见生物标志物检测原则(BINV-A)。2 L7 a5 @+ q$ j( S9 r* g
v.见男性乳腺癌的特别注意事项(BINV-J)。
" M& S3 Z4 E: Q9 E/ ~y.根据世界卫生组织的定义,非特殊型癌(NST)涵盖多种模式,包括髓样模式、9 B# z& ^: q$ v; p/ e8 u: j
cc.尽管IHC法检测ER,染色1%-100%的癌症患者被认为是ER阳性且适合接受内分泌治疗,但关于ER弱阳性(1%-10%)亚组癌症患者的数据有限 。ER弱阳性组存在异质性,据报道其生物学行为通常类似于ER阴性的癌症。在作其它辅助治疗和总体治疗路径的决策中应考虑到这一点。参见生物标志物检测原则(BINV-A)。# m% J! D3 h% M% v; W( W
dd.对于接受辅助治疗的绝经后(自然或诱发)患者,考虑予双膦酸盐辅助治疗。
" ~ ?+ J0 N8 W0 y# M/ cgg.支持70岁以上的患者接受化疗的数据有限。见《NCCN老年人肿瘤临床实践指南》。* M4 A; \# ~+ c9 u
hh.T1a和T1b期,淋巴结阴性的患者即使HER2扩增或过表达,其预后也不确定。目前尚没有研究该类人群的随机试验。该组患者是否使用曲妥珠单抗治疗必须权衡已知的曲妥珠单抗毒性(例如心脏毒性)和不确定的绝对获益后进行决策。
$ y1 D6 A$ @- e) O8 V" B' n1 B4 Nii.每周一次紫杉醇联合曲妥珠单抗的辅助化疗方案(Tolaney et al.NEJM 2015) 可考虑用于T1NOM0期,HER-2阳性的乳腺癌患者(特别是原发肿瘤激素受体阴性)。对于肿瘤大小接近T1mic(<1mm)的激素受体阳性乳腺癌患者,当预期复发风险低于5%而内分泌治疗可作为全身治疗的一个可行选择时,基于HER-2的全身治疗的绝对获益可能可以忽略不计。/ ~ k4 R" x( p" j
rr.见“术前/辅助治疗方案(BINV-L)”。
- k1 }8 v' l& m1 P
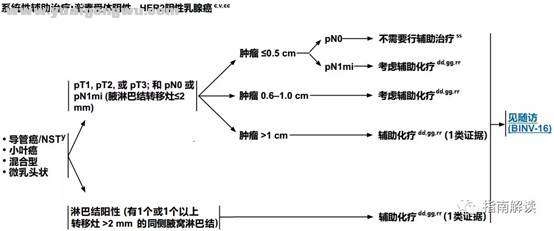
3 l, [: B7 I. j- D! |" q6 ABINV-9
) o$ @3 V9 C1 i2 u4 n) L' G( m激素受体阴性,HER2阴性乳腺癌
7 \- X: k6 E4 |' k6 Q! f3 E" e2 f3 _' b5 V3 H C4 H/ w
 : i8 \! {" u- g% ^
: i8 \! {" u- g% ^
& ~! k. ]) |2 ~8 M0 _0 @9 t脚注:, i4 L9 V7 I$ L5 u# l
c.见生物标志物检测原则(BINV-A)。
% T0 u7 [1 R a- T0 @ d* f* ?# Qv.见男性乳腺癌的特别注意事项(BINV-J)。+ I0 U5 n, g$ C8 ]$ `7 _
y.根据世界卫生组织的定义,非特殊型癌(NST)涵盖多种模式,包括髓样模式、& ~% P1 }& O# w+ Q2 t; b
z.有一些罕见的化生性癌亚型(如低级别腺鳞癌和低级别纤维瘤样癌),被认为在不接受辅助全身治疗的情况下预后良好。
$ [( o' G$ T! W4 e4 Y) O9 Fcc.尽管IHC法检测ER,染色1%-100%的癌症患者被认为是ER阳性且适合接受内分泌治疗,但关于ER弱阳性(1%-10%)亚组癌症患者的数据有限 。ER弱阳性组存在异质性,据报道其生物学行为通常类似于ER阴性的癌症。在作其它辅助治疗和总体治疗路径的决策中应考虑到这一点。参见生物标志物检测原则(BINV-A)。
- e4 o1 X, U6 N; F: W% ddd.对于接受辅助治疗的绝经后(自然或诱发)患者,考虑予双膦酸盐辅助治疗。1 O* @ b: ~! I0 g0 [
gg.支持70岁以上的患者接受化疗的数据有限。见《NCCN老年人肿瘤临床实践指南》。
) D1 G8 s9 E/ d5 F( Err.见“术前/辅助治疗方案(BINV-L)”。# k; G2 V+ ?7 J6 |+ G2 l. G1 X& F
ss.一些经过筛选的具有高风险特征的患者(例如,组织学为高级别的非常年轻的女性),可以考虑辅助化疗(2B类证据)。参见(BINV-L)。
4 ^1 ]$ G; x ^0 a9 ?6 l. n
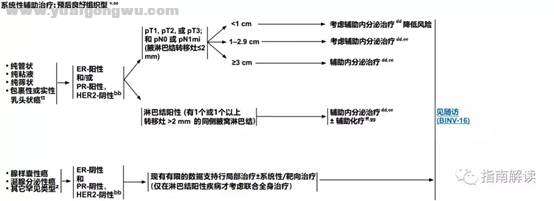
' M( Q+ U7 L9 qBINV-10
* F9 B) P: _* U' I9 z+ a$ L) R; O预后良好组织型" f% O$ d6 J- e1 y: [- }. [6 x
; p; ~$ H* J$ o2 Z3 a
 / L' m0 z% L0 \9 _
/ L' m0 z% L0 \9 _
: \3 w( V; \" f8 E1 c* G7 N2 i脚注:
% A0 e0 b# Z( F8 A% N( L; |5 X, ^v.见男性乳腺癌的特别注意事项(BINV-J)。
4 n# g- Z& P/ D9 n- Wz.有一些罕见的化生性癌亚型(如低级别腺鳞癌和低级别纤维瘤样癌),被认为在不接受辅助全身治疗的情况下预后良好。/ j' w6 x# S0 D' D4 _# Q
aa.良好的组织学类型与良好预后相关,但应是纯的(在手术切除标本上[不是单纯的芯针活检标本]良好组织学类型的比例> 90%),不含高级别癌且HER2阴性。如果存在非典型的病理或临床特征,请考虑按导管癌/NST治疗(请参阅BINV-4)。! H# R+ V; A; q, K& l% O4 x
bb.组织学、激素受体和HER2状态的相关性应始终在了解异常/不一致或临界结果的情况下进行。参见生物标志物检测原则(BINV-A)。
w! h' v; O! Q; P+ o2 C8 g& |dd.对于接受辅助治疗的绝经后(自然或诱发)患者,考虑予双膦酸盐辅助治疗。
2 M1 K* J$ o9 ^$ i0 S; v+ X, ~ee.证据支持激素受体阳性的绝经前女性乳腺癌患者从卵巢手术或放疗去势的获益程度与单用CMF相似。见“辅助内分泌治疗(BINV-K)”。+ g' D# ~" l; t7 I. M- r0 ^
ff.采用化疗和内分泌治疗联合方案行辅助治疗时应按照先化疗后内分泌治疗的顺序进行。现有数据表明,内分泌治疗加序贯或同步放疗是可以接受的。见“辅助内分泌治疗(BINV-K)”和“术前/辅助治疗方案(BINV-L)”。
( S+ K" i; y( X" c/ lgg.支持70岁以上的患者接受化疗的数据有限。见《NCCN老年人肿瘤临床实践指南》。! _$ S2 f) m1 Q7 v8 Y9 r) v
tt.不伴相关常见浸润的包裹性乳头状癌 (EPC) 被定为pTis期,因为其行为类似于DCIS(根据AJCC)。根据WHO标准,应将实性乳头状癌(SPC)指定为原位或浸润性,但两种形式均具有良好的预后。
- k. {. T* J7 X/ O. {0 |9 ^
% @1 @9 N* P# K. T' x% g- m. z
) \' E5 z. c: T3 }2 j# H) y
" X7 N1 z0 N, L0 c. M! p) Q
 ) [) U/ H, K6 T y8 H
) [) U/ H, K6 T y8 H
3 k0 o8 C" ]; M9 `4 T7 ~接受术前全身治疗的可手术乳腺癌(BINV 11~13)
0 z! \" J+ m$ w$ ~
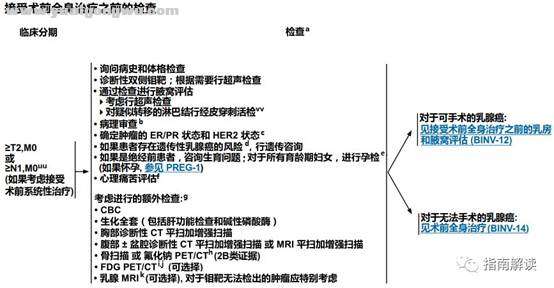
7 W: I7 f3 v% @ T' }# T8 uBINV-11% N) I- o' V, X1 X) `( v
接受术前全身治疗之前的检查
! z" i, @2 c0 T+ Z3 G
7 P2 F) H* i( r& [: b1 X
 2 a3 a5 R9 A- ~/ m) `
2 a3 a5 R9 A- ~/ m) `
/ V# J: } V+ K, e7 H脚注:
( m5 ? p+ K q1 |0 r! Aa.关于帮助老年肿瘤患者进行最佳评估和管理的工具,参见《NCCN老年人肿瘤指南》。
$ ~) E) U( X! a4 E4 e) _# `b.指南专家组支持所有浸润性和非浸润性乳腺癌的病理报告都遵循美国病理学家协会颁布的草案。http://www.cap.org。. T0 {, F9 |! I" ]$ K: x! r: ?% Q
c.见“生物标志物检测原则(BINV-A)”。
6 h$ `$ F6 `+ M) s( ~ ud.关于风险定义的标准,参见《NCCN遗传/家族性高风险评估指南:乳腺和卵巢》。& c* N* K/ o2 Q6 A% ^. o1 L* N" u# N
e.见“生育能力和节育问题(BINV-C)”。
, o# T, j3 o$ f- O$ h: `* ]f.见《NCCN心理痛苦管理指南》。 {( O! \) z+ q3 G
g.对于没有症状的早期乳腺癌,不推荐常规行全身分期。7 l" _) w. l( G
h.如果进行了FDG PET/CT检查并在PET和CT部分均清楚地指示骨转移,则有可能不需要再行骨扫描或氟化钠PET/CT。 Y( P q, q5 S% Q3 z
i.FDG PET/CT可在行诊断性CT检查的同时进行。临床I、II期或可手术的III期乳腺癌的分期并没有指征行PET或PET/CT扫描。FDG PET/CT最有助于标准分期检查难以判断或者存在疑问时的协助诊断(特别是对于局部晚期或转移性乳腺癌患者)。
9 r! w" W* E3 m1 tj.FDG PET/CT联合常规的分期检查方法,有可能检测出局部晚期乳腺癌病例中未被怀疑的区域淋巴结转移和/或远处转移。 ?& @' O' l6 U* B6 D3 ?
k.乳腺MRI可能有助于表征腋窝和/或内乳淋巴结转移性疾病。参见乳腺专用MRI检查原则(BINV-B)。
! p! f! p0 Y- Z. c3 B& duu.见“术前系统性治疗原则(BINV-M)”。
- e+ x3 P7 e2 p6 _7 ~vv.在腋窝淋巴结取样时,应放置夹子或进行染色标记,以用来核实活检阳性的淋巴结在根治性手术时已经被清除。: _" M* k/ @! Y8 X% W. u
4 q% n3 h, J+ C3 Q, V
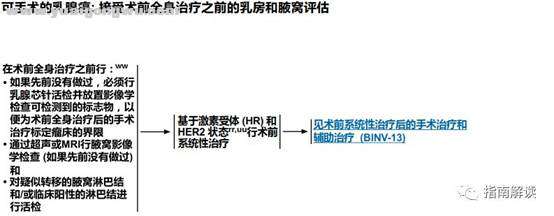
BINV-12 K8 {0 R! T" |5 o) X# A/ P- P
接受术前全身治疗之前的乳房和腋窝评估
' i1 {- J* F E2 u8 e. s! e
4 J7 S3 V2 w' b7 }; ~, I
 , \3 u# K9 m# s8 i1 y
, \3 u# K9 m# s8 i1 y : J+ ?1 m* F+ l
脚注:2 V* S8 X- @& M2 I# ^) d
rr.见“术前/辅助治疗方案(BINV-L)”。
?* r3 X Z9 tuu.见“术前系统性治疗原则(BINV-M)”。6 q! e6 O# q. F9 U: e5 ?
ww.如果淋巴结状态的确定会影响手术和/或系统性治疗的选择,可考虑在术前系统性治疗之前进行前哨淋巴结活检。
6 w$ D# M/ z; w ^; ]: \5 R9 i
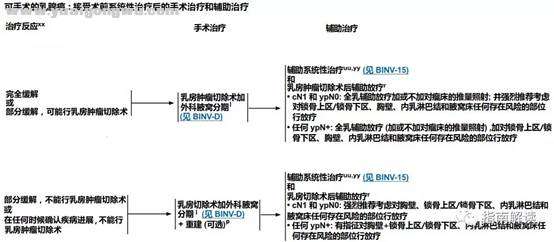
- x- K9 w2 d1 M/ a* g% hBINV-13
: Y4 W Z/ V( d" N术前全身治疗后的手术治疗和辅助治疗; I, R; c/ [0 ~5 y6 |
$ j+ R l8 T9 B0 G
 ( p8 y4 P# ?! `4 Z
( p8 y4 P# ?! `4 Z
# \! x& Y, _' z" M脚注:2 z1 {8 p: |' p" l j! [
l.见“外科腋窝分期(BINV-D)”。+ {" n, i7 b$ g9 P
p.见“术后乳房重建原则(BINV-H)”。
, S/ ?$ K0 |3 P( h; [3 V [7 m- r0 mr.见“放疗原则(BINV-I)”。
4 U$ U! A0 C# @$ c# ]! Z! W- @: p: fuu.见“术前系统性治疗原则(BINV-M)”。
0 a% F* `9 x3 {2 ]# ]xx.乳房内肿瘤或区域淋巴结对术前全身治疗的疗效难于进行准确评估,评估内容应包括初始肿瘤分期时的体格检查和影像学检查(钼靶和/或乳腺超声和/或乳腺MRI)的异常表现。术前影像学检查方法的选择应由多学科小组来决定。$ j5 g+ ^* _4 R
yy.如果术前未完成,请完成先前计划的化疗方案疗程。
6 R5 m, D# V9 r________________________________________
* F6 n2 Y* s6 K) s7 W - W0 W1 O5 e+ L6 w. ?
无法手术或局部晚期的非炎性乳腺癌(BINV-14,15)0 ~) _( V6 |: `- J0 p+ t
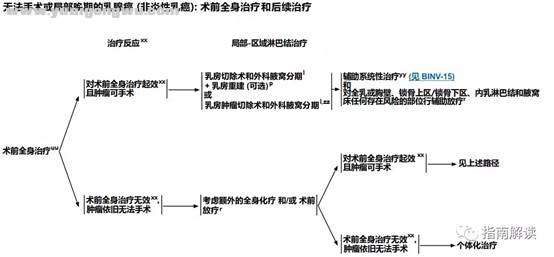
, s' F6 u1 g- L7 ABINV-146 T/ E. a( |3 q2 z) p
接受术前全身治疗后行局部-区域淋巴结治疗
( n( P0 K. T9 @- n7 a9 k6 N+ Y4 ?- f. C9 c2 a* G
 " _$ F7 k7 p% P5 {6 Z: y; I. }
" _$ F7 k7 p% P5 {6 Z: y; I. }
/ p: H8 K% r; y+ U3 W
脚注:) i3 I. p! @. G
l.见“外科腋窝分期(BINV-D)”。
i. f0 H6 i8 z% M- L- w3 Vp.见“术后乳房重建原则(BINV-H)”。7 N" f! K" X8 q. N8 o
r.见“放疗原则(BINV-I)”。
3 q# Q. r# w! P0 w$ `uu.见“术前系统性治疗原则(BINV-M)”。; ~5 X5 K( S' N0 n. m
xx.乳房内肿瘤或区域淋巴结对术前全身治疗的疗效难于进行准确评估,评估内容应包括初始肿瘤分期时的体格检查和影像学检查(钼靶和/或乳腺超声和/或乳腺MRI)的异常表现。术前影像学检查方法的选择应由多学科小组来决定。) g) z5 [/ @6 V( }7 X/ \5 |0 e
yy.如果术前未完成,请完成先前计划的化疗方案疗程。
' @& l. T! X! C2 T% }7 ^9 yzz.对于皮肤和/或胸壁受累的患者(T4,非炎性乳癌),在接受术前系统性治疗前,可基于多学科评估局部复发的风险,对一些经过严格筛选的患者行保乳手术。除了保乳手术的一般禁忌(见BINV-G)外,保乳手术的排除标准包括:接受术前全身治疗前诊断为炎性(T4d)乳癌的患者和接受术前全身治疗后皮肤受累病灶未完全缓解的患者。
8 s! e7 Y H2 T) a' y- G& \, i# b n$ M7 K* a ?+ I( t" ?. g. J
BINV-157 z) { Z q) p; E2 P) \
接受过术前全身治疗后的术后辅助治疗
( ~; r$ d9 m, \) H* m3 ?' B7 d
5 P: s( `) K- X( U2 h( n
 6 Q7 Z" ]1 B0 V$ j) [! R
6 Q7 Z" ]1 B0 V$ j) [! R
* Q# \; p9 M: L9 n8 x脚注:
# L' Q) I# Z2 _ff.采用化疗和内分泌治疗联合方案行辅助治疗时应按照先化疗后内分泌治疗的顺序进行。现有数据表明,内分泌治疗加序贯或同步放疗是可以接受的。见“辅助内分泌治疗(BINV-K)”和“术前/辅助治疗方案(BINV-L)”。: R. D" N1 F5 d6 |* Q
bbb.对于HR阳性,HER-2阳性并且认为有高复发风险的乳腺癌患者,在接受含曲妥珠单抗方案的辅助治疗后,可考虑予来那替尼(neratinib)延长辅助治疗。对曾接受过帕妥珠单抗或曲妥珠单抗抗体-药物偶联物(ado-trastuzumab emtansine)治疗的患者,接受来那替尼延长辅助治疗的益处或毒性尚不清楚。
( J, e" o b% X I. Uccc.如果有指征行HER2靶向治疗和/或内分泌治疗,则可以与放射治疗同步施行。如果有使用卡培他滨的指征,口服卡培他滨应在放疗完成后进行。
' V9 M0 {! R" H. k" s$ S & l8 I2 P6 G' j
% R! M- j# |! b! o/ ]& Q
8 x# j. F8 j2 ~; ^9 d
 $ A: F" _/ W/ }6 e2 D
$ A: F" _/ W/ }6 e2 D 0 L8 b% X5 J7 t3 I; R/ g
监测/随访(BINV-16)7 r7 v, B& W5 D* g, f, [
1 ?* w2 J& y: u) ^, W
 " ^' E$ k) s# `0 @& \
" ^' E$ k) s# `0 @& \
$ d @, U8 o' N- i* U# ^
脚注:
9 v) V4 ~# \6 H+ wddd.研究表明,对于接受保乳手术和放疗的患者,每年复查一次乳房X线摄片是适合的随访间隔,更频繁地进行监测并没有明显的优势。患者应在完成放射治疗后6至12个月开始进行每年一次的乳房X线摄片检查。体检或影像监测发现可疑异常的患者可能需要更频繁地复查乳房X线摄片。/ b( s! J% C3 c
eee.不鼓励使用雌激素、孕激素或者选择性雌激素受体调节剂用于治疗女性乳腺癌患者的骨质疏松或骨量减少。可使用双膦酸盐(口服/静脉)或地诺单抗来维持或改善骨矿物质密度和降低接受辅助内分泌治疗的绝经后(自然或诱发)患者的骨折风险。目前每一种治疗的最佳持续时间都尚未确定。是否应持续使用超过3年尚不清楚。影响抗骨质疏松治疗持续时间的因素包括:骨矿物质密度、对治疗的反应、继续导致骨丢失或骨折的风险因素。已有停用地诺单抗后发生自发性骨折的病例报道。接受双膦酸盐或地诺单抗治疗的患者在开始治疗前应先行口腔预防的牙科检查,并且应补充钙剂与维生素D。
. V: }4 j+ c, K, i5 z# Y________________________________________
4 w. u2 v* l" d2 X6 ^ ^+ ] x6 a8 b+ T: O$ L6 i* V
复发/IV期乳腺癌的检查(BINV-17)+ o/ ~' M) r! A- x [$ D0 i
3 s* d! ~8 X- a
 4 M0 @$ I- G# L( M5 a4 y
4 M0 @$ I- G# L( M5 a4 y
8 X( f' ?' G8 `( e8 Y脚注:
3 ]0 N4 j- X1 \+ x, ?6 u/ g# F- Ja.关于帮助老年肿瘤患者进行最佳评估和管理的工具,参见《NCCN老年人肿瘤指南》。# h6 p4 i% X) M* N! ]
c.见“生物标志物检测原则(BINV-A)”。0 u( w5 @! a$ {' r% I" M7 O
d.关于风险定义的标准,参见《NCCN遗传/家族性高风险评估指南:乳腺和卵巢》。! |# }& K$ I& D' b& Q' T5 H5 U
h.如果进行了FDG PET/CT检查并在PET和CT部分均清楚地指示骨转移,则有可能不需要再行骨扫描或氟化钠PET/CT。
) ?3 P9 V F" F, L( n) t$ ]( tj.FDG PET/CT联合常规的分期检查方法,有可能检测出局部晚期乳腺癌病例中未被怀疑的区域淋巴结转移和/或远处转移。% B. S, ~; z& V
fff.FDG PET/CT可与诊断性CT检查同时进行。FDG PET/CT最有助于标准分期检查难以判断或者存在疑问时的协助诊断(特别是对于局部晚期或转移性乳腺癌患者)。
& i, m D% D0 Tggg.ER和/或PR结果存在假阴性可能,且原发灶与转移灶的ER和/或PR结果可能不一致。因此,无内脏转移或无症状的内脏转移患者可考虑接受内分泌治疗,特别是临床特征预示为激素受体阳性肿瘤(例如,无病间隔期长、复发部位局限、疾病发展缓慢、患者年纪较长)的患者。
2 u, k5 J2 D7 }2 h* nhhh.在无法安全获取活检组织但是临床证据强烈支持复发的临床情况下,可基于原发肿瘤的ER/PR/HER2状态开始治疗。# w% ]& T3 t X1 S! J/ ^
iii.见《NCCN姑息治疗指南》和《NCCN支持治疗指南》。" N/ ]# t8 g3 R1 }/ c1 `% A, ^1 l
jjj.有关脑转移的治疗,请参见《 NCCN中枢神经系统肿瘤指南》。+ K. O1 d" _% l7 w
________________________________________
* T+ N! v/ d4 {& ~8 j- U, d2 G
' |1 f; d) b+ S% E局部和区域复发乳腺癌的治疗(BINV-18)
' V+ B( [' R8 u- J, Y) b : y7 T. P3 F' g% }) t" |
 3 K4 }5 m- W4 `7 K1 |" [
3 K4 }5 m- W4 `7 K1 |" [
8 S3 a. a& ^- Z脚注:5 a9 M1 H5 O% P1 }! i& @8 U
r.见“放疗原则(BINV-I)”。
$ y9 d" b- P, G& P% @kkk.多学科讨论在乳腺癌复发患者的治疗中尤为重要,以考虑所有潜在的治疗方法来达到最佳治疗结果。
' A7 z+ E, {8 d1 dlll.对于先前进行过前哨淋巴结活检(SNB)的保乳手术患者,如果术后出现乳腺局部复发,再次行SNB在技术上可能是可行的。但再次进行SNB的准确性尚未经证实,并且在乳腺肿瘤切除术后再次进行SNB的预后价值目前尚未可知,因此不建议再次进行SNB检查。7 N' Q4 A; P0 P, R+ F9 w% z
mmm.如果无法手术切除并非因为技术原因,考虑行全身治疗直至最佳缓解,然后如果可能行手术切除。2 c) d5 b/ W/ D
nnn.采用放疗治疗局部复发的决策必须考虑到该部位先前所有接受的照射以及先前照射和计划照射的总量造成远期正常组织毒性的风险等因素。
0 d) h, k0 ]/ t& d; [+ Aooo.额外的信息请参阅“讨论”部分。3 v% y* [9 x" n& ^. J
________________________________________ m! {* l; O" s/ i: L
' M+ a3 w! z& @
复发或IV期乳腺癌的全身治疗(BINV 19~25)( T+ {9 e: ?2 _) n& O0 H: ^1 E& }
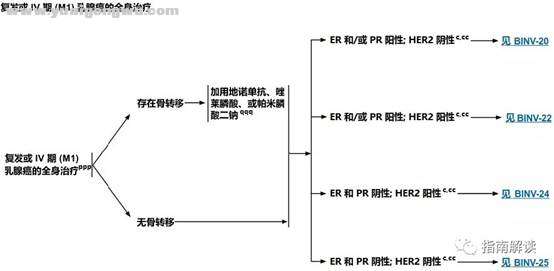
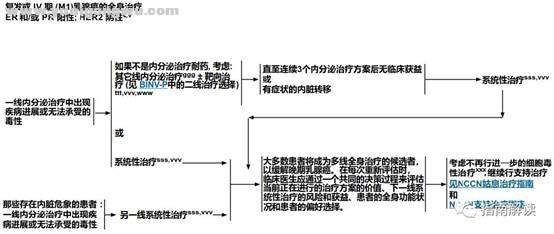
( n. q& d: `) }1 ~* _. I0 Y" iBINV-19
! ], \) O' y' T4 }6 G" _: S复发或IV期(M1)乳腺癌的全身治疗7 J: y# P& U1 W4 M" {9 g6 H/ R
9 b1 [- Q5 r) ]/ R+ r( y
 ) B3 D2 b" }; O
) B3 D2 b" }; O + R+ T1 S5 w1 J! c
脚注:- a0 O$ z$ c( `
c.见“生物标志物检测原则(BINV-A)”。
; M# m1 c" {9 Z/ V: j% g y+ a; V" \cc.尽管IHC法检测ER,染色1%-100%的癌症患者被认为是ER阳性且适合接受内分泌治疗,但关于ER弱阳性(1%-10%)亚组癌症患者的数据有限 。ER弱阳性组存在异质性,据报道其生物学行为通常类似于ER阴性的癌症。在作其它辅助治疗和总体治疗路径的决策中应考虑到这一点。参见生物标志物检测原则(BINV-A)。8 f, q; w1 z4 f+ g- y6 N
ppp.对于重新表现为IV期(M1)的乳腺癌患者,原发肿瘤手术切除的作用和时机是当前正在研究中的课题,必须个体化。对于一些初始全身治疗有效的选择性患者,乳房手术和/或放疗等局部治疗是可行的。% |- j8 @$ N+ n
qqq.如果存在骨转移、预期寿命≥3个月且肾功能足够,在化疗或内分泌治疗的同时,应加用地诺单抗、唑来膦酸或帕米膦酸二钠(均同时补充钙和维生素D)(1类证据)。患者在开始此治疗前应先接受口腔预防的牙科检查。唑来膦酸的最佳给药方案是每12周给药一次。
7 x6 V. H: v0 ~8 I
' N; b" U! a2 M' o V. S, T& eER和/或PR阳性、HER2阴性
( Y% c; C! D+ [2 g" Q0 C" n) O* L& H
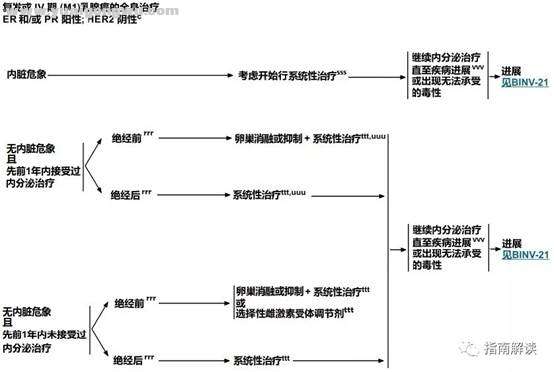
BINV-20
; k, U2 }! W: i. G7 B5 U+ }" A7 v( F6 E7 c4 S( ?( I |" Z
 " Q% N2 S- r9 g( R! C
" Q% N2 S- r9 g( R! C
# U% x- N0 k5 q5 _( I1 A' K脚注:
1 P( ?2 i9 [# b1 w/ mc.见“生物标志物检测原则(BINV-A)”。3 s' D3 W% \% w# E4 q
rrr.见“绝经的定义(BINV-O)”。4 h9 i$ ~( M8 T9 `8 a$ L2 ^" r6 h
sss.见复发或IV期(M1)乳腺癌的系统性治疗方案(BINV-Q)。
0 s8 F% X% o) Sttt.见ER和/或PR阳性复发或IV期(M1)乳腺癌的系统性治疗(BINV-P)。' ]0 s( e- i0 y# m$ {3 b
uuu.如果在初始内分泌治疗过程中出现进展,请换成另外一种不同的内分泌治疗选项。
2 B) i* f% h0 H5 s+ v- k7 tvvv.见远处转移乳腺癌的监测原则(BINV-S)。
6 g8 F: c0 h d# p # d5 e6 c% k/ b3 h
BINV-21
1 p+ m" {7 H& b: r: x; @
, i1 J* e1 i' i% Y& S9 R
 2 `4 u+ U" f: N" @! a# n6 g
2 `4 u+ U" f: N" @! a# n6 g
" G7 a* j; t' G8 q8 C1 _/ I2 T7 O脚注:* U' @/ l& O6 `2 G; C7 ]
c.见“生物标志物检测原则(BINV-A)”。
1 e4 t) T7 A/ G- K/ ^& lv.见男性乳腺癌的特别注意事项(BINV-J)。2 M# Q" Y8 z7 X$ L1 Z
ggg.ER和/或PR结果存在假阴性可能,且原发灶与转移灶的ER和/或PR结果可能不一致。因此,无内脏转移或无症状的内脏转移患者可考虑接受内分泌治疗,特别是临床特征预示为激素受体阳性肿瘤(例如,无病间隔期长、复发部位局限、疾病发展缓慢、患者年纪较长)的患者。5 u& _1 X! G) p
sss.见复发或IV期(M1)乳腺癌的系统性治疗方案(BINV-Q)。0 H9 w) B2 d( E% Z% U) E& r
ttt.见ER和/或PR阳性复发或IV期(M1)乳腺癌的系统性治疗(BINV-P)。
2 b* e: J- ` M0 e" v. b6 ?/ Bvvv.见远处转移乳腺癌的监测原则(BINV-S)。% @3 l, I3 s- ~) ?7 b6 ~* z2 V; t
www.如果在接受CDK4/6抑制剂治疗期间出现疾病进展,仅有有限的数据支持用另一种含CDK4/6的方案进行下一线的治疗。同样,如果在接受含依维莫司的方案治疗中出现疾病进展,没有数据支持用另一种含依维莫司的方案进行下一线的( i6 H3 n8 v: y+ {7 ]
xxx.对于全身体能状况达不到标准的患者,额外化疗带来的潜在副作用可能会超过所有临床获益。必须将患者的偏好选择考虑在内。+ J9 w ]( v8 n4 [" J& I2 z0 D
: K+ d4 ^" g% p3 p# e- G
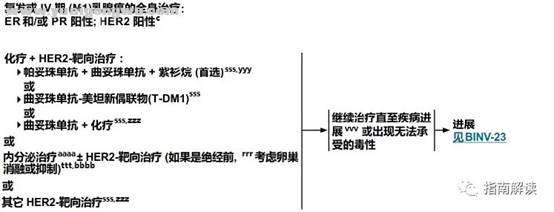
ER和/或PR阳性、HER2阳性2 Y: ]$ {2 q: U; k* _! \9 Z, @
! G" Z3 T' |: b, t* ]: D9 nBINV-22- q. p* {+ N5 V! j
1 ?9 T: @; [$ C$ N) {
 + g2 I3 _/ U. v; p% ]6 i
+ g2 I3 _/ U. v; p% ]6 i $ M; Y' A9 l. ]! U7 o
脚注:: u$ B9 Q9 z* O- I/ M( \) |; b
c.见“生物标志物检测原则(BINV-A)”。/ w0 K& \ t0 ^
rrr.见“绝经的定义(BINV-O)”。3 _' v* {% @' \9 e& k9 Y8 r
sss.见复发或IV期(M1)乳腺癌的系统性治疗方案(BINV-Q)。. H; v! q( Q, h5 a1 w1 F1 ~
ttt.见ER和/或PR阳性复发或IV期(M1)乳腺癌的系统性治疗(BINV-P)。
0 d' Z6 o1 F2 gvvv.见远处转移乳腺癌的监测原则(BINV-S)。
4 z4 L$ U# I. O6 ~yyy.如果初始采用“化疗+曲妥珠单抗+帕妥珠单抗”治疗,并且化疗已经停止,可以在“曲妥珠单抗+帕妥珠单抗”中加入内分泌治疗。0 i4 T9 U Y" R: y& i
zzz.曲妥珠单抗与蒽环类药物联合使用时可引起显著的心脏毒性。应避免将曲妥珠单抗和帕妥珠单抗与蒽环类同步使用。
9 [& Q- o6 G5 M7 }5 Haaaa.如果在过去1年内接受过内分泌治疗,考虑采用一种不同的内分泌治疗方案。
/ B7 V$ ~ h/ o% c; u3 A8 {* Wbbbb.对于绝经前女性,单独使用选择性ER调节剂(不行卵巢消融/抑制)+ HER2靶向治疗也是一种治疗选择。
; M8 N4 G: d: i. _/ i4 m" _ $ H+ V8 M) Z0 E# O
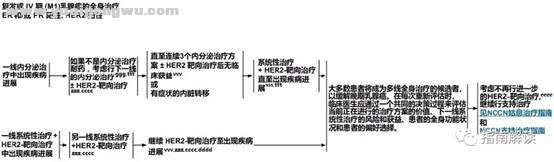
BINV-23
! r9 J1 r2 m! U/ P" k: h, {$ q7 ]+ B- Y7 \) k
 8 v: v4 O% @" o/ \
8 v: v4 O% @" o/ \
) K6 j: [; U* G8 w
脚注:
\" n9 ]2 ?& N( S) s/ C1 Xc.见“生物标志物检测原则(BINV-A)”。
' }) A# Y \+ H. d) s4 j4 Aggg.ER和/或PR结果存在假阴性可能,且原发灶与转移灶的ER和/或PR结果可能不一致。因此,无内脏转移或无症状的内脏转移患者可考虑接受内分泌治疗,特别是临床特征预示为激素受体阳性肿瘤(例如,无病间隔期长、复发部位局限、疾病发展缓慢、患者年纪较长)的患者。
) P6 ?+ G( T' B0 ]# A; D' esss.见复发或IV期(M1)乳腺癌的系统性治疗方案(BINV-Q)。 F, ]" X9 q- j7 H: |( H& n' n! A
ttt.见ER和/或PR阳性复发或IV期(M1)乳腺癌的系统性治疗(BINV-P)。 \- O0 J; A* w6 t, e1 f& a
vvv.见远处转移乳腺癌的监测原则(BINV-S)。
# S. a5 ?- z( o2 h# Pzzz.曲妥珠单抗与蒽环类药物联合使用时可引起显著的心脏毒性。应避免将曲妥珠单抗和帕妥珠单抗与蒽环类同步使用。
- T) r' v+ l$ e: h) l% v" x3 T) Occcc.对于先前接受过“化疗+曲妥珠单抗”治疗但没有用过帕妥珠单抗的患者,可考虑采用某一线包括“曲妥珠单抗+帕妥珠单抗”的治疗,联合或不联合细胞毒药物治疗(如长春瑞滨或紫杉烷)。抗HER2治疗的理想序贯策略还需要进一步研究。
# D: p7 i2 ?4 ?- hdddd.对于一线接受“HER2靶向治疗+化疗”后出现疾病进展的转移性乳腺癌患者,继续接受HER2靶向治疗。对于疾病得到长期控制的患者,曲妥珠单抗的最佳给药持续时间尚不明确。+ B0 y$ r# y% `+ x
eeee.对于全身体能状况达不到标准的患者,额外HER2靶向治疗带来的潜在副作用可能会超过所有临床获益。必须将患者的偏好选择考虑在内。' _4 t4 X) h3 x8 Y
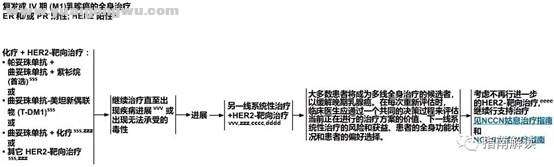
2 n% n# a# E; J' d7 O8 h( AER和PR阴性、HER2阳性4 _6 h9 q6 w. P9 y# u/ B
+ Y' ^6 k- @7 cBINV-24+ ~0 ]; O D; i6 l4 u5 q8 \2 @
4 p; a1 ]/ L1 @7 p; k; N
 ; n( v/ u! m! f1 E
; n( v/ u! m! f1 E
* J* w- v, g+ R1 E p: l6 N脚注:
* z$ j9 \# w1 k. ac.见“生物标志物检测原则(BINV-A)”。, Q' \( v$ ?$ m- c9 Y
sss.见复发或IV期(M1)乳腺癌的系统性治疗方案(BINV-Q)。
) Y- Q: q( F1 N: kvvv.见远处转移乳腺癌的监测原则(BINV-S)。2 ] e% ^. U9 x8 `. b. p( H
zzz.曲妥珠单抗与蒽环类药物联合使用时可引起显著的心脏毒性。应避免将曲妥珠单抗和帕妥珠单抗与蒽环类同步使用。- r% I4 i: Q4 S6 K A' f: C$ q7 ] L- K2 R
cccc.对于先前接受过“化疗+曲妥珠单抗”治疗但没有用过帕妥珠单抗的患者,可考虑采用某一线包括“曲妥珠单抗+帕妥珠单抗”的治疗,联合或不联合细胞毒药物治疗(如长春瑞滨或紫杉烷)。抗HER2治疗的理想序贯策略还需要进一步研究。1 j: A5 k9 I5 h# k% s' }" p
dddd.对于一线接受“HER2靶向治疗+化疗”后出现疾病进展的转移性乳腺癌患者,继续接受HER2靶向治疗。对于疾病得到长期控制的患者,曲妥珠单抗的最佳给药持续时间尚不明确。4 g I. }( i! ]! @3 J4 {
eeee.对于全身体能状况达不到标准的患者,额外HER2靶向治疗带来的潜在副作用可能会超过所有临床获益。必须将患者的偏好选择考虑在内。) P, F- y) ?- q
4 u9 z$ N! s/ D ~- @ER和PR阴性、HER2阴性
4 y+ l {: I% x h, y) ~0 }1 q0 t% ~, h R: k5 Z9 a
BINV-259 s" Y7 y5 \3 _
. O4 y. d" \/ N b9 g K/ Y
 ) T8 t& K% @1 g0 a7 u: Q) Y
) T8 t& K% @1 g0 a7 u: Q) Y
/ @) I) S1 E/ [ j6 ?2 W脚注:
( Y0 Z9 _# u0 Q3 H2 m. Z& Tc.见“生物标志物检测原则(BINV-A)”。
( ~+ [3 u9 \0 m0 _8 J7 i, \sss.见复发或IV期(M1)乳腺癌的系统性治疗方案(BINV-Q)。
# p+ H/ q# f5 d/ ^( T* b2 ovvv.见远处转移乳腺癌的监测原则(BINV-S)。
; c! h6 R; S& r5 h3 g% \% {eeee.对于全身体能状况达不到标准的患者,额外HER2靶向治疗带来的潜在副作用可能会超过所有临床获益。必须将患者的偏好选择考虑在内。1 t! q0 Q( R4 S3 |
ffff.对于三阴乳腺癌(TNBC),评估肿瘤浸润免疫细胞上的PD-L1表达,以识别是否接受“阿特珠单抗+白蛋白结合型紫杉醇”治疗的候选者。评估胚系BRCA1/2突变,以识别是否接受PARP抑制剂单药治疗的候选者。请参见复发或IV期(M1)乳腺癌的附加靶向治疗和相关生物标志物检测(BINV-R)。
0 x' H L1 H3 J$ `/ U& D
Y% Y9 n2 y9 Y3 T7 d2 d) Q
 7 n+ p" a/ U- x
7 n+ p" a/ U- x ; h/ \7 i, j `1 u
生物标志物检测原则(BINV-A)+ j( n+ |! h( P4 u6 k1 l5 i8 Y
& X+ d4 G. G: u+ j4 @
BINV-A,1/2
+ ?9 W6 I- H' y/ g) v' w! |0 LHER-2检测& ]; E4 i: P' @* N, p& v$ E
! O/ A$ V+ g( }7 V4 w( G
●应使用ASCO/CAP HER2检测指南中概述的方法对所有新的乳腺癌原发灶或新的乳腺癌转移灶进行HER2检测。a
- r/ J0 }: V4 m: Y●如果病理学报告为1级(任何组织学类型)、纯粘液性、纯小管性或纯筛状癌,HER2检测结果呈阳性,则应重新审查病理结果并考虑重新行HER2检测或对HER2检测结果进行会诊讨论。a
9 w, o9 p5 c; P2 p1 @●如果初始活检样本HER2检测结果呈阴性,而初始样本欠佳(如存在微浸润癌、冷缺血时间或固定欠佳)、估计检测结果可能错误、或其它样本含有较高级别的形态学上与活检样本不同的癌症,则考虑对后续的手术样本或其它额外样本进行重新检测,以排除高级别癌症的异质性,或者将有助于临床决策。a
4 g+ Z1 |4 r3 D8 O$ Y. [$ R( D6 E) S0 X! i& C( n( N' S4 R8 g
 ' L- e" {* n2 a! G9 u9 l5 H+ E
' L- e" {* n2 a! G9 u9 l5 H+ E 4 I' R. I) T/ y7 ?0 m" k& Q
脚注:) n( S( h( ]0 {: L! t- x6 s
a.NCCN支持遵循ASCO/CAP HER2检测指南。“HER2检测原则”经许可改编自“Wolff AC, Hammond EH, Allison KH, etal. Human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Focused Update. J Clin Oncol 2018;36:2105-2122.”
/ k D7 ~, b# e' `b.实验室必须参加HER2检测的质量保证认证计划。否则,应将组织标本送经过认证的实验室进行检测。医疗保健系统和供应商必须合作以确保最高质量的检测。: K1 T$ D3 h: u4 h5 @5 V' X! O
c.来自曲妥珠单抗辅助试验的证据显示,采用原位杂交(ISH)或免疫组化(IHC)检测HER2有类似的预测HER2靶向治疗临床获益的用途。9 k, E; V& Q: L, Z& ], ^$ \
d.单探针ISH检测不是首选推荐。但是,如果使用该方法检测,4.0信号/细胞≤平均HER2拷贝数<6.0信号/细胞的病例,应基于同步进行的IHC的最终结果,如果IHC结果是2+,则应进一步行双探针ISH检测。0 n. v0 ~4 t0 g! g" R/ \
e.ISH第2-4组,最终的ISH结果是基于对同步进行的IHC的审查,如果IHC结果是2+(按2018年CAP/ASCO更新建议),则由第二位评审员对ISH检测进行重新计算。对于这些ISH组中最终报告为阴性结果的,建议提供附加的报告报告注释。( c) ^; k, u+ F8 ~
4 G, e- A: x, z$ U+ @% K5 mBINV-A,2/2
: o: ]. s6 e9 r/ K+ R8 R激素受体检测2 c8 J: i+ s: P
3 g/ @$ t9 _8 u" q# P! r( k
●所有新诊断的原发性乳腺癌或新发转移性乳腺癌,都应使用最新ASCO/CAP激素受体检测指南中概述的方法,通过ICH法进行激素受体(ER和PR)检测 (Allison KH, Hammond ME, Dowsett M. et al. Estrogen and progesterone receptor testing in breast cancer. American Society of Clinical Oncology/College of American Pathologists Guideline Update. Arch Pathol Lab Med. doi: 10.5858/arpa.2019-0904-SA)。DCIS应检测ER(不需要检测PR)。
0 `' D/ d! s/ Y7 u/ I●应使用ER检测来确定患者是否适合内分泌治疗。
- |, u; A- ?: {►ER表达阳性的细胞占1%-100%的癌被认为是ER阳性。ER阳性的患者被认为适合接受内分泌治疗(适用于DCIS和浸润性癌)。2 n1 _" Z- D! S j" p
►ER阳性率在1%-10%之间的浸润性癌被认为是ER弱阳性。关于内分泌治疗在这一组患者中的获益数据有限,但它们提示内分泌治疗可能带来益处,因此这些患者被认为适合接受内分泌治疗(如上所述)。然而,需要注意这组存在异质性;ER弱阳性的癌,其生物学行为可能与ER阴性的癌更为相似。在作其它辅助治疗和总体治疗路径的决策中应考虑到这一点。
% S0 A0 o$ ^, e% f% b+ X% m►染色<1%的癌被视为ER阴性。尚未显示ER阴性的癌症患者可从内分泌治疗中获益。
5 g" E+ g4 u/ O# `+ z, l8 a+ P4 p●实验室应具有标准的操作程序,以最大程度地提高ER染色<10%或染色强度较弱病例检测结果的准确性和可重复性(避免假阴性)。对于结果为ER染色<10%或染色强度较弱的病例,应报告对照的状态。/ z+ K1 q0 I; N _4 i# ? i
●对于浸润性癌,通过IHC法检测PR,有助于进行癌症的预后分类,并可作为ER结果有可能为假阴性的病例的一个对照。ER阴性,PR阳性的癌症患者可以考虑进行内分泌治疗,但需要注意该组的数据有限。使用的总体解释原则相同,但PgR应据不同情况来解释是阳性(如果1%-100%的细胞存在核染色)或阴性(如果<1%的细胞或没有细胞存在核染色)。
5 n& z0 m) l. \/ A& B, s●病理科医生解释任何ER结果应包括评估与每个病例的组织学结果的一致性。当结果不寻常时,临床医生应当注意并与病理科医生协作尝试解决(如再次检测或会诊)或解释非典型的报告结果。见下表。1 A2 E% X2 [6 w/ i/ v- Q
: A7 x0 s1 n: C' \/ @, P
 * M+ P5 e' q$ s A
* M+ P5 e' q$ s A ________________________________________/ c/ |) y5 z6 [
0 q: \5 j4 f7 _* |! {" Y乳腺专用MRI检查原则(BINV-B)
4 X! G4 R( H5 p6 Z% J- B* H* {# E0 G8 g , ?* F* L3 U% Z1 C, t0 ^" U; o
乳腺癌高危妇女接受MRI筛查的指征见《NCCN乳腺癌筛查和诊断指南》。
+ z; E* g; M* y8 o: B5 S
' D8 w! @1 A) W: [# C. `/ t, T; Y- ]人员、设施和设备 \& l# H5 h9 N6 N. F& n" B: f
●乳腺MRI检查应使用静脉对比剂增强扫描,且应由专业的乳腺影像工作团队来阅片,该团队应与多学科治疗团队相呼应。
6 g: ^ x; n' e. j●乳腺MRI检查需要使用乳腺专用的线圈,由熟悉阅片最佳时序和其它技术细节的乳腺放射影像医生进行。影像中心应该有能力进行MRI引导下的穿刺取样和/或对MRI检查发现的结果进行影像引导定位。
. [, n) |8 ^& r% d B! S* \6 d 9 Z8 U1 f( _0 \# O% q B, X. W
临床适应症和应用7 d6 I5 E: g; Z+ u; D2 |: j
●可用于分期评估以确定同侧乳腺肿瘤范围、是否存在多灶或多中心性肿瘤,或在初诊时筛查对侧是否存在乳腺癌(2B类证据)。尚无高水平数据证明使用MRI可以帮助局部治疗的决策来改善局部复发或生存期。13 W' U. P8 l/ y& _4 N! V j& H4 M
●可能有助于术前全身治疗前后乳腺癌的评估,以确定肿瘤的范围、对治疗的反应以及是否可行保乳治疗。( a/ L7 P* Z: V L4 |2 {' v
●可能有助于确定乳房X线摄片(钼靶)、超声或体检难于确定(或无法充分确定)的女性原发肿瘤隐匿(或不明)的腋窝淋巴结腺癌、佩吉特氏病、或浸润性小叶癌。
6 j2 @- j0 C0 S. V2 A* o: L●乳腺MRI检查常有假阳性结果。不能仅凭MRI的发现来决定手术。建议对乳腺MRI发现的可疑区域进一步行组织取样。
) v5 T& T+ P1 z, H# i●对于先前诊断有乳腺癌患者的随访筛查,MRI的价值尚不明确。一般仅考虑用于那些主要基于家族史模型推算、在其一生中患第二原发乳腺癌的风险高于20%的人群,例如那些具有乳腺癌遗传易感风险的人群。5 ^0 P. ]+ m) P( r& D" D
/ P% x% P0 L: X1 F: S: D( Y$ _3 X脚注:
& r" s. b9 u: m" S, O1.Houssami N, Ciatto S, Macaskill P, et al. Accuracy and surgical impact of magnetic resonance imaging in breast cancer staging: systematic review and meta-analysis in detection of multifocal and multicentric cancer. J Clin Oncol 2008;26:3248-3258.) X& A9 b: u% r9 W9 E" j! {4 s& Q
________________________________________
5 K' i0 h$ `) F; T- F4 Y6 r# d: j
% K/ u5 B# b. X9 {' \% d' v生育能力和节育(BINV-C)- ~; f& f# Y2 Y$ U C2 ~
+ z- L) l9 f- c' F- [" u: y$ E
见《NCCN青少年和年轻成人肿瘤指南》) K- F4 |, i9 K
●所有绝经前患者应被告知化疗对生育的潜在影响,并询问其未来是否可能有生育意向。未来可能有生育意向的患者在化疗和/或内分泌治疗之前应转介生育专科医生以根据患者特异性、肿瘤的分期和生物学(决定治疗的紧急程度、类型和顺序)来讨论作何选择。讨论的内容还包括保留生育能力的时机和持续时间、卵母细胞和胚胎冷冻保存以及其它不断发展的技术的选项、乳腺癌治疗完成后成功怀孕的概率。- P6 Z% H; i- J: c1 ]: m! e6 ?
●尽管化疗过程中或化疗后经常出现停经,但是大多数年龄小于35岁的妇女在完成辅助化疗后的2年内恢复月经。
! A3 P$ P0 L9 \& v, e9 C●月经状况和生育能力并非总是相互关联。月经不规则,尤其是服用他莫昔芬者,不一定代表没有生育能力。相反,月经正常并不代表一定具备生育能力。有关化疗后生育能力的数据十分有限。
* p- x% g& f) t, o: @2 m●患者在接受放疗、化疗或内分泌治疗期间,或在接受曲妥珠单抗或帕妥珠单抗治疗期间或治疗完成后6个月内应避免怀孕。
7 e* Q# s- b9 M3 a. O●尽管数据有限,但是无论患者癌症的激素受体状态如何,都不推荐使用基于激素的方法进行避孕。
]6 @, v2 {5 [9 K2 C●其它节育方法包括使用宫内节育器(IUD)、屏障法、或对于将来不想怀孕者行输卵管结扎或对其伴侣行输精管结扎术。
& a7 l$ @6 I) ?: |●随机试验显示,绝经前乳腺癌患者(无论激素受体状态如何),辅助化疗期间给予GnRH激动剂治疗进行卵巢抑制,可能保留卵巢功能,降低化疗诱发闭经的可能性。
# B* |1 h5 _* y●保乳治疗后进行哺乳并非禁忌,但是剩余乳房分泌的乳汁质和量可能不足,或可能缺乏某些所需的营养成分。不建议在化疗和内分泌治疗的积极治疗期间或在接受曲妥珠单抗或帕妥珠单抗治疗完成后6个月内哺乳。
( \" k# X4 F* m' p8 w% v( @! G●有关GNRH激动剂治疗对ER阳性乳腺癌患者生育能力保护的历史经验较少,报告结果相互冲突。
6 d8 L9 y% s) D, P5 b6 |( o6 v________________________________________
; B* A4 Y- @# ?- {3 n! _& e
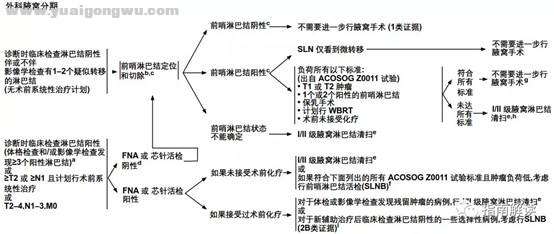
& B* s. }4 j2 D5 C m9 q8 z外科腋窝分期(BINV-D)
- F& J _5 Z0 K+ N* w) O4 B 6 b) L! w5 Y8 E+ _8 ]/ s
 - f/ I# u& E4 e; _+ y
- f/ I# u& E4 e; _+ y ' |5 ?( f( @/ [8 Z$ v
脚注:3 ?5 [2 t) [4 |; a
a.临床检查阳性的淋巴结,可考虑行超声引导下细针穿刺活检或芯针活检,以病理确诊是否为恶性。7 {# u4 m& |) `7 p1 H: l! \' C+ s
b.前哨淋巴结定位的注射可以在肿瘤周围、乳晕下、或皮下。- c6 _( c, m; U1 c- r9 A) Y
c.前哨淋巴结是否受累需通过淋巴结多层切片H&E染色来确定。细胞角蛋白免疫组化(IHC)染色可用于H&E结果模棱两可的病例。在作临床决策时,不推荐常规应用细胞角蛋白IHC染色来确定淋巴结是否受累。: ]9 S2 E4 K6 T, e4 P6 T) y
d.如果化疗前腋窝临床阴性而化疗后前哨淋巴结阳性,则考虑进行腋窝淋巴结清扫或进行多学科肿瘤团队讨论是否适合行腋窝放疗而不进一步手术。+ u3 R% J7 w- X3 C
e.见腋窝淋巴结分期(BINV-E)。
' D/ w9 V w8 w3 O: j1 E: v8 [f.腋窝肿瘤负荷低是指符合以下2个特点的淋巴结病变:1)影像学检查发现但临床体检不明显;2)貌似限于1个或2个腋窝淋巴结。& A4 ^ P" D+ b/ ?
g.对于接受乳房切除术的患者,如果初始淋巴结临床阴性,SLNB发现淋巴结阳性而未行腋窝淋巴结清扫,放疗范围应包括胸壁、锁骨上淋巴结±内乳淋巴结。5 s- I$ I& X) ^8 ~$ s2 n
h.对于接受全乳切除以及计划行放疗的临床腋窝阴性患者,腋窝放疗可代替I/II级腋窝淋巴结清扫进行疾病的区域控制。
& m4 B" U) ?' L. a J8 c# {, ti.对于术前系统性治疗之前显示淋巴结阳性的患者,接受术前系统性治疗后SLNB假阴性率> 10%。通过使用双示踪剂标记活检的淋巴结以记录它们的切除情况和通过切除2个以上前哨淋巴结,可降低假阴性率。
# E4 r' f7 h! r0 j& k" \, ] s________________________________________# ? c0 z% y! [% w1 _" y
9 N" k0 h5 U3 N/ P- P3 \2 K# L! b
腋窝淋巴结分期(BINV-E)+ n; ?8 i! Y R9 V, `8 o
7 m9 U6 _: K) j0 d●如果患者适合做前哨淋巴结活检(SLNB),应进行前哨淋巴结活检,并且是腋窝淋巴结分期的首选方法(见BINV-D)。
' Q- t& c8 _; v●在缺乏确切数据证实施行腋窝淋巴结清扫术能延长患者生存期的情况下,对于肿瘤预后特别良好的患者、不影响辅助全身治疗和/或放疗选择的患者、老年患者、或存在严重合并症的患者,实施腋窝淋巴结清扫术是可选的。
6 U. m6 P3 p& m) y! `6 G●只有II级和/或III级腋窝淋巴结存在肉眼可见转移的病例,才考虑施行范围达胸廓入口的III级腋窝淋巴结清扫。
' x2 k( T& n, q2 s$ v●若II级腋窝淋巴结不存在肉眼可见病灶,则淋巴结清扫应该包括从背阔肌边缘到胸小肌内侧缘的腋静脉下方组织(I/II级)。8 p6 K5 T9 [5 W5 k- v
●i.淋巴水肿是腋窝淋巴结手术治疗后由于淋巴系统受损而引起的一种潜在副作用。淋巴水肿的早期发现/诊断是优化治疗的关键。对于有淋巴水肿危险因素的患者,考虑在基线时预先进行双臂测量。参见NCCN癌症生存者指南:淋巴水肿(SLYMPH-1)。$ z8 h- y. i; D! u
________________________________________
# k7 ?6 d9 r9 f1 [ H+ p 2 g+ x3 Z, V, M& ?* r. H( v$ y) D
DCIS和浸润性乳腺癌的切缘建议(BINV-F)' f+ r1 T( f% g+ d
* B F5 y( T6 n+ s5 U0 c' S% s
BINV-F,1/2
1 l; h1 A+ |4 q+ Y1 O. B
7 z9 ]3 q- y/ ]/ A: W* _●对保乳手术(BCS)的所有手术标本均应进行切缘评估,最佳切缘评估的要求包括:
1 O5 M; z! ]' V5 y/ Q►手术标本定位
* W5 T/ p( L1 y7 C6 d►肉眼和镜下所见切缘状况的描述
9 l8 X: M2 F5 v. Y. `+ B" _►报告肿瘤与切缘最近的距离、方位及肿瘤类型(浸润性癌或导管原位癌)。3 i3 L) z' ], a6 }7 e" ]* \1 K
●对于乳房X线摄片发现有微钙化的DCIS,应通过对切缘的分析和对标本行影像学检查来证实完全切除。当不能确定切除是否充分时,也可在切除术后行乳房X线摄片。* r, ~% }0 h8 F+ o# [. J+ X( F9 u0 h
●保乳手术的应用以能达到病理阴性切缘为前提。关于保乳治疗后阴性切缘的定义,对于I/II期浸润性癌,NCCN专家组接受摘自2014年外科肿瘤学会(SSO)—美国放射肿瘤学会(ASTRO)切缘指南1的定义;对于DCIS,NCCN专家组接受 2016 SSO/ASTRO/ ASCO指南2的定义。对于保乳手术后的I期或II期浸润性乳腺癌患者,阳性切缘定义为“肿瘤上墨染”(任何浸润癌或DCIS细胞有墨水)。这些患者一般需要进一步手术——或再次切除以达到阴性切缘,或接受全乳切除。切缘阳性者一般都需要接受进一步的手术治疗——或再次进行切除以达到阴性切缘,或接受全乳切除手术。如果再次切除在技术上可做到保乳并达到“肿瘤上无墨迹染色”,则可沿初次切除标本阳性切缘的定位方向再次切除或沿原先的整个手术腔隙再次切除。可能有部分III期的浸润性乳腺癌患者适合接受保乳手术。对于这些患者,切缘状态将按类似的定义进行评估。) {- z8 q# T- F, Z) `' d# Y
5 j+ j7 j) y$ v
DCIS
7 Q: ]: c1 u( g4 h& _8 e/ ^! `●对于接受保乳手术和全乳放射治疗(WBRT)治疗的纯DCIS患者,所有切缘边距至少达2 mm的定量描述与降低同侧乳腺肿瘤复发(IBTR,与边距过窄有关)的风险相关,而并没有证据支持常规获得大于2毫米的边距可以进一步改善预后。当切缘附近仅有微小或局灶DCIS侵犯时,可根据临床判断来决定在个体情况下是否可以避免行再次切除。7 ^) S, g# M# H* A
●对于单纯接受切除术(未接受WBRT)治疗的DCIS患者,无论边距如何,同侧乳腺肿瘤复发(IBTR)的发生率要比切除联合WBRT组的患者高得多,即使在预定义为低风险的患者中。尽管单纯接受切除治疗的最佳边距尚不清楚,但应至少达2 mm,有证据表明当边距大于2mm时可以改善IBTR发生率。4 N6 Q i' A9 m( Q8 T+ ~; }
●导管内原位癌伴微浸润(DCIS-M),定义为浸润性病灶的大小≤1 mm;当考虑最佳切缘边距时,应参照DCIS切缘的定义(>2mm)。DCIS-M主要是由DCIS组成,该病灶的全身治疗更接近参照DCIS的治疗模式,而非参照浸润性癌的治疗模式。5 v& O' J# B4 H" k& c" ~, Y, f+ ?
. e- G3 c' m( J( U2 B0 o! x
脚注:5 P6 } c8 |& M2 E8 K0 i! g
1.Moran MS, Schnitt SJ, Giuliano AE, et al. Society of Surgical Oncology-American Society for Radiation Oncology consensus guideline on margins for breast-conserving surgery with whole-breast irradiation in stages I and II invasive breast cancer. J Clin Oncol 2014 May 10;32(14):1507-15.; N v1 r7 K0 J% @
2.Morrow M, Van Zee KJ, Solin LJ, et al. Society of Surgical Oncology-American Society for Radiation Oncology-American Society of Clinical Oncology Consensus Guideline on Margins for Breast-Conserving Surgery With Whole-Breast Irradiation in Ductal Carcinoma In Situ. J Clin Oncol 2016;34:4040-4046.
( g @ k% v8 `- l4 v* ?5 H* j$ Y3 k5 O5 n) M5 d& x+ p
BINV-F,2/2+ B. U( y- c( y; ]% g
0 ? O) g8 B/ D浸润性乳腺癌
5 S$ z. |( L7 T8 z% a2 z* J; b●具有DCIS成分的浸润性乳腺癌,无论DCIS的范围如何,“肿瘤无墨染”的阴性切缘定义应基于浸润性的切缘指南。在这种情况下,无论是DCIS还是浸润性癌细胞,都建议“肿瘤无墨染”,主要是因为这些病灶的自然病史、治疗和预后,对比DCIS,都与浸润性癌更相似。对于一些与患者讨论后,患者对于再次切除保持谨慎的特殊情况,应根据临床判断来决策。
: ]# ]' D$ C9 s$ q. W9 c; H●这些切缘建议不能直接用于接受加速部分乳腺照射(APBI)的患者,2关于这部分患者局部复发的数据更有限。此外,应在逐个研究个案的基础进行个体化临床判断,进行术后乳房X线摄片来确定残留钙化和临床病理因素(如切缘附近病灶的定量范围、是否存在广泛导管内成分[EIC])、根据发病年龄是否年轻、是否多个切缘过近,来帮助识别IBTR风险可能增加的患者,并因此可能选择通过再切除获益。9 }* s" ^: G5 N0 _
●对于接受保乳手术后的浸润性乳腺癌患者,如果切缘镜下局灶阳性而没有广泛导管内成分(EIC),3应考虑对瘤床进行较高剂量的推量照射。对复发风险较高的患者,建议对瘤床进行推量照射。常用的剂量为10-16 Gy,2Gy/f。
/ M; A% K1 }1 m9 f1 ^- V
4 n) y' W1 E8 o. G0 t脚注:$ ?# |/ C/ d h# S$ j
2.Morrow M, Van Zee KJ, Solin LJ, et al. Society of Surgical Oncology-American Society for Radiation Oncology-American Society of Clinical Oncology Consensus Guideline on Margins for Breast-Conserving Surgery With Whole-Breast Irradiation in Ductal Carcinoma In Situ. J Clin Oncol 2016;34:4040-4046.6 ]! c! O5 U5 u
3.EIC is defined as an infiltrating ductal cancer where greater than 25% of the tumor volume is DCIS and DCIS extends beyond the invasive cancer into surrounding normal breast parenchyma. } o% n; O0 y9 q) j; u. b9 X
) x6 [! v* c1 k0 c* A8 W
B( h* K% g8 h( v% s6 Z7 ?) z' A8 T2 Y( }0 N/ {
 . L& @) @8 W8 I' P
. L& @) @8 W8 I' P
$ X+ T" P8 d4 b3 C- a
需要接受放疗的保乳治疗的特别注意事项(BINV-G)$ E- X G# g1 I3 N
' n7 L3 m( {, y9 Y2 {
需要放疗的保乳治疗禁忌证包括:0 p5 J2 g( ^% E- M: n
绝对禁忌证
$ U- E6 w% O' L: R, I8 k! P●妊娠期间放疗' b4 f, ~. |) K/ x8 i, ?% \
●弥漫可疑或貌似恶性的微钙化灶0 p3 _& U+ J( C G5 G' D# `. [
●病灶范围广泛,不可能通过单个区域或节段乳腺组织的局部切除就获得阴性切缘及满意的美容结果
+ s: B- w9 l5 P$ S0 }0 ]' E●弥漫性的切缘病理检查阳性a
; r6 ?* d8 _7 V. l●ATM基因纯合子突变(双等位基因失活)(2B类证据)8 \0 F( Q" h% ~4 J- a) J9 T
7 t- m; B. l7 p. ]* C- T8 r' Z相对禁忌证0 l- K$ i. w1 I5 ~" |! L
●先前接受过胸壁或乳腺放疗;必须知道处方剂量和体积。
+ n& y8 r# U' R! C) P●累及皮肤的活动性结缔组织病(尤其是硬皮病和狼疮)/ {' o8 C$ F5 ?/ G) S+ i
●切缘病理检查阳性a
- s/ [$ y) t2 K& J●已知或疑似有乳腺癌遗传倾向的妇女:
0 S% T+ P3 r4 |( I►接受保乳治疗的患者,同侧乳腺癌复发或发生对侧乳腺癌的风险增加* h/ X" J" r% n
►可考虑行预防性双侧乳腺切除以降低风险。(见NCCN乳腺癌和卵巢癌遗传/家族性高风险评估指南) w( j+ r0 s' R" Q& _ a4 X
►已知或疑似有李-佛美尼综合征(2B类证据) [) j E+ a4 g6 b6 @
+ ~) @' ^6 L: W. n \) G脚注:8 A/ d9 P! X9 m3 W# x2 V
a.见DCIS和浸润性乳腺癌的切缘建议(BINV-F)。" n! ~+ Y+ [" t
________________________________________3 g7 \7 H+ l' X5 `' p% f
2 l' w, {" o6 z* P术后乳房重建原则(BINV-H) 3 F7 ]& }/ p# q5 p0 p
) c4 I+ _4 M+ o& i% \% w2 s5 X% lBINV-H,1/25 B' w) v: Q0 V7 z4 ~0 O6 ^' M
# C) D( n/ r( d3 r8 X●所有接受乳腺癌手术治疗的女性患者都可选择乳房重建的方案。所有正在接受乳腺癌治疗的女性都应接受乳房重建方案方面的宣教,宣教内容需适应其个人临床情况。但是,乳房重建不应影响适当的癌症手术治疗。与重建外科医生的协调咨询和手术治疗应在合理的时间框架内执行。乳房重建过程不应左右疾病适当的手术治疗时机和范围。乳房重建的可用性或可操作性不应造成延误或拒绝适当的手术干预。
6 |4 r2 u" n- B. N% Z: u- g●应在术前对肿块切除后可能的外观效果加以评估。在切除本身可能造成外观效果无法接受的情况下,保乳整形技术可扩大保乳手术方案的范围。这些术式的应用可以降低对乳房切除术需要,降低二次手术重新切除的可能性,同时尽量减少乳房畸形。应告知患者的阳性切缘的可能性以及二次手术的潜在需要,这可能包括节段性再次切除,或可能需要伴有或不伴乳头缺损的乳房切除术。整形手术可与对侧未受累乳房的手术合并进行,以减少远期的不对称性。& ?1 a0 @" U' L, Z
●对于乳房切除术,应讨论乳房重建的可能性,并在术前考虑重建方案。乳房切除后的乳房重建手术方案包括:' s: P0 Z4 b$ L* v& r# P( h+ F1 g
►结合乳房假体埋置的术式(例如扩张器置入继以假体埋置、立即假体埋置)! ]" | d" R; `- U$ P" [1 N1 @+ @2 R
►结合自体组织移植的术式(例如单蒂TRAM皮瓣、脂肪移植术、取自腹部、背部、臀部和大腿的显微外科皮瓣)
9 B/ T* E7 ^6 ]' H& a% m►结合乳房假体和自体组织移植的术式(如背阔肌皮瓣)
9 ^3 U- M/ k: `8 f●乳房切除后的乳房重建术可以在乳房切除的同时进行(“立即”),也可以在肿瘤治疗结束后某个时间进行(“延迟”)。在很多情况下,乳房重建涉及需要一种以上术式的分阶段方法,如:
, j$ N& Z6 L. P& U8 }/ x3 a; e5 i►改善对称性的对侧乳房手术
3 ]; u2 W7 X" U9 X8 \. _0 a►涉及乳房和/或供体部位的翻修术) E/ V* ~. f( H8 r; \! D' }% q
►乳头和乳晕重建和纹身着色4 B. ^* S) m- L4 h8 P& H
●不论是何种乳房切除术,都存在局部和区域复发的风险,有证据表明保留皮肤的乳房切除术与标准乳房切除术在这方面的风险相当。保留皮肤的乳房切除术应该由经验丰富的乳腺手术团队来进行,这一团队应以团结协作、多学科参与的方式进行工作,来指导合适患者进行保留皮肤的乳房切除术、决定重建术在辅助治疗中的最佳顺序、以及通过手术获得适当的手术边距。采取保留皮肤的乳房切除术治疗的病例仍应当行乳房切除术后的放疗,遵循标准乳房切除术的相同选择标准。- Z$ i! T8 k5 E8 l* M
●在炎性乳腺癌(IBC)接受乳房切除的情况下,禁忌立即行乳房重建,原因是复发风险高、疾病有侵袭性质以及需要迅速完成术后放疗来实现局部控制,不能有任何拖延。因为保留皮肤的乳房切除术尚未证明对于IBC是安全的,所有需要在切除乳房时切除当前或既往累及的皮肤。因此,在这种情况下立即进行乳房重建并无益处。4 W( Q( ~! x& S* a, w: F# B
/ J/ w3 \6 Q" y S+ ^BINV-H,2/2$ h# s" x8 M& S5 W W& K
4 q- l% a, R2 d4 [- c. `3 v+ n●一般来说,为了治疗肿瘤,保留皮肤的乳房切除术需切除乳头乳晕复合体(NAC)。但是,经有经验的多学科团队严格选择的癌症患者也可采用保留NAC的术式。对于乳房体积小-中等和下垂轻-中度(术前乳头位置可以接受)的乳头受累率低、局部复发率差不多和并发症率低的早期和局部晚期浸润性癌和/或导管原位癌患者的保乳治疗,回顾性数据支持采用保留NAC的术式。术前存在乳头受累临床证据的患者(包括佩吉特氏病、与恶性肿瘤相关的乳头溢液、和/或影像学结果提示乳头或乳晕下组织受恶性病变累及),禁忌保留乳头。务必行乳头切缘的评估,并且应清楚地标识乳头切缘。
( D2 ?) B7 ?0 }' h; o; f●可以在先前接受过放射的患者进行重建(在乳房切除术和放疗之后的延迟重建或在先前保乳后行乳房切除术的患者进行的即时重建)。对于乳房切除术和放疗后延迟重建的患者,首选自体组织重建。在这种情况下,组织扩张器/假体重建可导致包膜挛缩、错位、美容效果下降、假体外露和重建失败的风险明显增加。* X0 T0 L. m9 m5 b" W
●对于先前接受过保乳治疗后进行乳房切除术的患者,假体重建比自体组织重建的并发症发生率更高,但根据术前因素和术中考虑,对于经过适当筛选的患者可考虑进行假体重建。* K; Q; ^4 Q5 w, z
●虽然乳房切除术后照射不是非炎性局部晚期乳腺癌即刻重建的绝对禁忌,无论重建方法仍然应该考虑重建方法的应用:
1 v4 i# ]% I# y' H, I* D►如需行乳房切除术后放疗并计划采用自体组织重建乳房,则在放疗结束后进行延迟重建术,也可初始在乳房切除时先置入组织扩张器,其后再进行自体组织重建。虽然一些经验丰富的乳腺癌团队采用即刻组织重建后接放疗的方案,由于报告的重建美容效果上的损失,一般仍首选将放疗放在自体组织置入前进行(2B类证据)。) m2 R! ?7 a+ J: E2 b
►需要放射治疗的患者在计划假体重建时,首选即刻组织扩张器置入后假体埋植的分阶段方法。将组织扩张器更换为永久性假体的手术可在放疗前进行,也可在放疗结束后进行。根据术前因素和术中考虑,可考虑在一些经过适合筛选的需要术后放疗的患者中立即进行假体埋植。
8 B/ N" O6 u/ n- _, | T●重建术的选择是基于肿瘤治疗、患者身体状况、肥胖程度、吸烟史、合并症及患者意愿的评估。吸烟和肥胖增加各类乳房重建术(无论是使用假体还是皮瓣)的并发症风险。因此吸烟和肥胖被视为是乳房重建术的相对禁忌证,必须让患者知道吸烟和肥胖会让伤口愈合并发症、皮瓣部分或完全坏死的发生率增加。3 U' E5 S4 u9 D0 C
●若患者在乳腺癌治疗完成后对外观结果不满意,应请整形外科会诊。
' d3 x' }- M; Z8 y) s9 q________________________________________
3 c: R# {4 X" Y; ]3 M9 W, z0 C* |5 K$ {
8 x6 L4 f( W# x放疗原则(BINV-I)
1 O6 f7 m* E1 _, _' ]- c, b$ X: A \6 u! u) A
优化个体化治疗的实施8 H, f. X' r$ B# i R' R
●放疗计划和实施的个体化很重要。
7 y+ I& N# F, \6 r [►鼓励基于CT的治疗计划来勾画靶区和存在风险的邻近器官。
$ Z& W8 ~; Y2 X$ P; ~►乳房/胸壁和淋巴结区的放疗通常使用光子±电子递送。3 ^* Q. D/ @" s3 m
►巨大靶区剂量的均匀性和正常组织的保护可以利用补偿器如楔形物、使用分段正向规划以及调强放射治疗(IMRT)来实现。
" j2 j$ g1 e( e& H/ W% `6 [►可尝试使用呼吸控制技术,包括深吸气屏气和俯卧位,以进一步降低邻近的心脏、肺和邻近的正常组织的照射剂量。
: u) c" Q% p# }' m5 ^& N►在保乳治疗情况下,推量照射可以使用表浅电子、光子或近距离放射治疗来实现。当有指征行胸壁瘢痕推量照射时,通常使用电子或光子治疗。
" m: G: x4 X# a( l1 ~►每周进行一次影像学检查验证每日设置的一致性。当使用一些技术(如俯卧位乳房照射)时,进行更频繁的影像学检查可能是合理的。不建议每天常规进行一次影像学检查。
$ m0 I: {! D; k5 l% D , i+ Z# P- e8 ]/ O
全乳照射
, I: R7 a8 a, {# F* x●靶区界定为整个乳房组织。5 C2 e/ `! }; J' H* ~" q/ o. E
●放疗剂量:; k# w. {, p5 n: ^
►全乳应接受45-50.4Gy/25-28f或40-42.5Gy/15-16f(首选低分割)。
& w; s8 @* K9 p; A2 S A►在复发风险较高的患者中,建议对瘤床推量照射。具有代表性的追加剂量是10-16Gy/4-8f。2 c1 e; a' E5 p, {. j+ t
●所有剂量方案都是每周照射5天。4 z8 S0 L7 {: L" q# C
* `' l$ t2 G/ j D8 t胸壁放疗(包括乳房重建)! H3 j! V% v1 o- ?
●靶区包括同侧胸壁、乳腺切除术后瘢痕以及当有指征时的引流部位。( s- p% j( z* ~& ?' n
►根据患者是否已行乳房重建术,可以合理选择光子和/或电子照射数种技术。2 b* @0 J: I. a" g8 J5 n
►鼓励应用基于 CT的治疗计划系统,以明确肺和心脏的体积,从而最大程度地减少对这些器官的照射。
; B, M, s" o& H2 Z►须特别考虑填充材料的使用以保证合适的皮肤剂量。
, M; T; I( d( r" r) u►放疗剂量:
/ u; n7 J: |( H* w# d7 Y4 s◊剂量为胸壁45-50.4Gy/25-28f±疤痕推量1.8-2Gy/f,至总剂量大约为60Gy。
) S. U# Z6 K8 x! i" o: D* i●所有剂量方案都是每周照射5天。
7 E8 K; Y% _* a$ x; U7 o; i& [2 P 9 q* I8 Z' c7 |; l4 o' k: ?
区域淋巴结照射
2 p, H( _0 @+ y; Z●使用基于CT的治疗计划系统可最好地实现靶区定位。3 R- ]# h8 h; X) q0 R6 s2 L9 J
►对于锁骨旁和腋窝淋巴结的照射,深度取决于患者的解剖情况。
! o0 e& A9 K: `6 | P! `►对内乳淋巴结的定位,由于其在影像上常看不到,可用内乳动脉和静脉的位置作为替代标志。根据乳房切除术后照射随机试验和近期的其它研究,当实施区域淋巴结照射时应强烈考虑对内乳淋巴结链(包括第1、2、3肋间隙)的照射治疗。当行内乳淋巴结放射治疗时,应使用剂量-体积直方图(DVH)以评估剂量限制、正常组织(即心脏,肺)的照射剂量和计划靶区(PTV)。; F$ V( j* G* _" c' A
►放疗剂量:1 H9 h) @' B, d! {3 h
◊区域淋巴结照射野的剂量为45-50.4Gy/25-28f。# l2 u n- x# |' L# x8 E
●所有剂量方案都是每周照射5天。
/ R) U# X6 _9 ^3 B+ | [9 w+ i $ B6 v/ Q7 ?* S" ?/ P# r. k
部分乳房加速照射(APBI)
- e- A2 j& w, a. `●APBI研究显示,对于一些选择性的早期低风险乳腺癌患者,APBI的局部控制率可能与标准的全乳放疗相当。然而,与标准的全乳房照射相比,一些研究表明接受APBI治疗在美容效果上存在劣势。但随访数据有限且研究尚在进行中。% W0 T0 i6 s5 Q
►鼓励患者参与临床试验。/ O. M; R* \% P9 S4 l
►NCCN专家组采纳美国放射肿瘤学会(ASTRO)2016年更新版APBI指南的建议,定义“适合”APBI的患者应符合以下条件之一:
2 V: I5 U! I5 M" n8 M( G◊1)50岁或50岁以上的浸润性导管癌,测量≤2cm(T1),阴性切缘边距≥2mm,无LVI,ER阳性和BRCA阴性;或
# L7 f% I N) S+ c" K6 X% \) ?2 I◊2)低/中度核分级,筛查发现的DCIS测量尺寸≤2.5cm且阴性切缘边距≥3mm。: b3 p+ o7 x" V% H0 x
►放疗剂量:$ D/ h' T* H8 l) S/ N
◊采用瘤床近距离放射治疗,剂量34Gy/10f,每天照射2次;或采用光子外照射,剂量38.5Gy/10f,每天照射2次。
$ t L1 J( z- V( Q* O& U◊其它分割方案目前尚在研究中。
+ g5 z# ]9 K5 {: N2 ~- h. q
, x4 ~. {0 Q Q& y8 y2 }' X3 L术前系统性治疗, z& h9 c1 g, u0 i8 s/ W
●对于接受过术前系统性治疗的患者,辅助放疗应基于诊断时(在接受术前系统性治疗之前)最高的疾病分期(即临床分期、病理分期、肿瘤特征)和在接受术前系统性治疗之后的病理结果进行考虑。( p$ A J2 z$ P: F% N5 h* i
________________________________________4 e! ]' V7 Y8 A3 \
7 I, n. P+ P; W, {! N5 `% b
男性乳腺癌的特别注意事项(BINV-J): g% V0 ^+ ^5 T3 \
) E, I9 t4 F. B* ?* w0 t1 }BINV-J,1/26 h: k& ~6 G5 W( V) I- D5 W
' y% z9 w8 B( z' ]) n
●很少有男性被纳入乳腺癌试验中。1因此,关于男性乳腺癌管理的建议通常是从针对女性乳腺癌的临床试验结果推断出来的。
) O% E' O7 I/ k& R; Y, L●尽管男性乳腺癌和女性乳腺癌在生物学和临床上存在着一些不同,男性乳腺癌的管理总体上与女性乳腺癌的管理相似,以下是与男性患者有关的特殊考虑因素:2' v! @0 E6 }) |/ v$ R
►遗传:NCCN专家组建议考虑对所有男性乳腺癌患者进行基因检测(参见NCCN遗传/高风险评估指南:乳腺癌、卵巢癌和胰腺癌)。
( F' }7 U& i, Q% ~; J3 G7 y►乳房手术:在历史上,男性乳腺癌患者更常接受乳房切除术,多于接受保乳手术。然而,有越来越多的男性正在进行保乳治疗,并且逐步发展中的数据表明男性患者接受保乳手术的疗效与接受乳房切除术相当且安全可行。男性患者选择进行保乳手术或乳房切除术,应根据与女性患者相似的标准来做决策。2-9
4 W- d/ u0 {0 |! h- @4 U$ {9 W►腋窝淋巴结手术:与女性患者一样,临床上腋窝淋巴结阴性的男性乳腺癌患者应行前哨淋巴结活检。2,4; u+ Y0 e: g; B! b5 B" n
►放射治疗:男性乳腺癌患者在乳房手术后的放疗指征与女性乳腺癌患者相同。2,5,10,11+ u7 v: B% F1 |6 d z
►分子学检测的用途:有关使用分子学检测评估男性乳腺癌患者预后和预测化疗获益的数据有限。1现有数据表明,21基因分析复发评分可为男性乳腺癌患者提供预后信息。12,13; d, C5 E; U0 ^
►术前/辅助全身治疗:推荐根据女性乳腺癌指南对男性乳腺癌患者进行化疗加/不加HER2靶向治疗。2用于男性乳腺癌的辅助内分泌治疗选择包括口服他莫昔芬5-10年,或者,如果存在使用他莫昔芬的禁忌症,则使用GnRH类似物加一种芳香化酶抑制剂。在男性患者中,单独使用一种芳香化酶抑制剂进行单药辅助治疗与单独使用他莫昔芬辅助治疗相比疗效结果较差,这可能是由于雌二醇抑制不足,不推荐使用。2,14-17. T* Z h n. Y+ R8 o
►早期乳腺癌治疗后的随访:男性早期乳腺癌患者治疗后不需要常规进行乳房X摄片检查。2NCCN专家组建议接受GnRH类似物辅助治疗的男性乳腺癌患者,检测基线骨密度并且以后每2年复查评估一次。骨密度应根据标准指南进行管理。18
3 O( m$ Y9 a) e7 H5 W b7 Z9 s►晚期乳腺癌的系统治疗:男性晚期乳腺癌患者的治疗与女性患者相似;但是,当使用芳香酶抑制剂时,优选同步给予GnRH类似物。现有数据表明,单药氟维司群在男性患者和女性患者中的疗效相似。19新的一些药物,如CDK4/6抑制剂与一种芳香化酶抑制剂或氟维司群联用、mTOR抑制剂和PI3CA抑制剂尚未在男性乳腺癌患者临床试验中进行系统性评估。但是,现有的真实世界数据显示出类似的疗效和安全性,并且根据主要由女性患者参与的晚期乳腺癌研究的数据推断向男性乳腺癌患者推荐使用这些药物是合理的。关于男性晚期乳腺癌化疗的适应症和建议,与女性晚期乳腺癌相似。1+ N' F; q5 I4 }" ]0 E
2 `- \9 O2 C6 t; l" s4 W. Y. uBINV-J,2/2
% T3 U N4 X3 K: ^9 M& R参考文献
9 m& F! _4 L+ ^ s * D! I6 E* K3 _) O8 o$ @" j+ T
 : K. T! B0 u' g
: K. T! B0 u' g
. N" o! s$ n% T4 B J1 I
+ ^ a1 _( ]5 {4 ]0 [1 y
+ V* P' B1 Y$ w
 . s0 Y+ `" A7 ]
. s0 Y+ `" A7 ]
" G1 `, W$ p( y D! h- Z: M
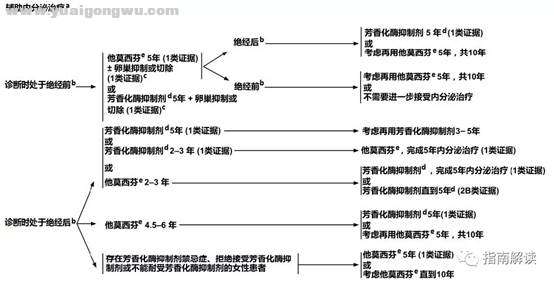
辅助内分泌治疗(BINV-K). {, Q* n4 @/ U
5 f- M1 Q8 ^& Q" [( l- y) G+ h. x( g4 ^
 6 a! D) ^( @, c8 Y
6 a! D) ^( @, c8 Y
' B* z* |# w# E# W8 U& u脚注:
2 X7 _) s. D+ _1 {) }a.如果不是绝经后患者,建议对激素状态进行序贯评估,以考虑使用另一种内分泌药物。
- K8 R* B. }6 x7 Y7 |b.见“绝经定义”(BINV-O)。
- P5 Q* P1 A- a" Qc.权衡卵巢抑制治疗相关风险和获益的讨论至关重要。基于SOFT和TEXT临床试验的结果,对于存在较高复发风险(如发病年龄轻、高级别肿瘤、淋巴结受累)的绝经前女性患者,应考虑接受“芳香化酶抑制剂或他莫昔芬5年+卵巢抑制”治疗。( k; k }$ l, o7 Q3 E0 n3 K
d.可供选择的三种芳香化酶抑制剂(即阿那曲唑、来曲唑、依西美坦)在辅助和新辅助治疗情况下的随机研究中显示出相似的抗肿瘤疗效和毒性反应特征。芳香化酶抑制剂在辅助治疗中的最佳治疗持续时间尚不确定。' @" N0 E9 C' S* {. c
e.一些5-羟色胺再摄取抑制剂(SSRIs)如氟西汀和帕罗西汀会减少4-羟-去甲基他莫昔芬(endoxifen,他莫昔芬的一种活性代谢物)的形成,因而可能影响他莫昔芬的疗效。他莫昔芬应慎与这些药物合用。但是,西酞普兰和文拉法辛似乎对他莫昔芬的代谢影响极小。目前,根据现有的数据,对于考虑接受他莫昔芬治疗的患者,专家组并不支持常规检测CYP2D6。应慎与CYP2D6的强抑制剂合用。
/ J+ B6 V; e z* m! j) c3 A6 U$ @3 `________________________________________! T* S$ G9 \; v. C
3 t/ R) L3 [8 |4 E术前/辅助治疗方案(BINV-L)
' ]3 ]$ N9 B: c6 _
- n" n, g" ]9 B SBINV-L,1/6
% w# H- G0 c1 n* o( a4 WHer-2阴性乳腺癌术前/辅助治疗方案' q( }# j( c0 K0 B
$ C1 N4 v9 R h; x
 " K- B2 w$ i6 ~" w6 \ T
" K- B2 w$ i6 ~" w6 \ T
' l. H \" ~: S U; S* l0 J x脚注:) ]4 G+ }6 ?% J) V9 [
a.回顾性证据表明,以蒽环类为基础的化疗方案在HER2阳性肿瘤患者中可能优于非蒽环类为基础的方案。
% Y0 j1 l: ]& ]% y2 _: y* \; [b.随机临床试验表明,将紫杉类加入基于蒽环类的化疗方案改善治疗结果。
) i5 ~* }: C9 l; z# j1 h, ^: |c.CMF和放射治疗可以同步给予,也可先给予CMF。所有其它化疗方案应在放疗前给予。
7 h1 `, `5 P5 z2 q6 P' F: I5 Dd.化疗和内分泌治疗联合进行辅助治疗时应按照先化疗后内分泌治疗的顺序进行。
6 g- r7 S. P; H* o: v: u+ Ge.由于医疗上需要(如存在过敏反应)时,白蛋白结合型紫杉醇可以替代紫杉醇或多西他赛。如果代替每周一次的紫杉醇或多西他赛,那么每周一次的白蛋白结合型紫杉醇剂量不应超过125 mg/m2。
: @5 \! d+ e( l2 T7 rf.考虑头皮冷却,以降低接受化疗的患者因化疗引起脱发的发生率。含蒽环类药物的方案效果可能较差。
1 k& u: i: Y) d- N/ a6 j6 @g.针对HER2阴性乳腺癌列出的方案在辅助治疗的情况中使用时均为1类证据(除非有另外说明)。
% W( w0 q% S; j+ Y, \- ~1 Q/ B) [% V. D# yh.改变给药顺序,先给予紫杉醇再给予剂量密集型AC是可以接受的。
9 r3 i$ F0 B) u r" y% di.卡培他滨 1000-1250 mg/m2,口服,每天2次,第1-14天,每21天为一个周期×6-8周期。Masuda N, Lee SJ, Ohtani S, et al. Adjuvant capecitabine for breast cancer after preoperative chemotherapy. N Engl J Med 2017;376:2147-2159.
* m1 U# v1 z( U0 O& g- L8 Ej.铂类药物用于TNBC新辅助化疗仍存在争议。数项研究表明,合并使用铂类药物高了pCR率。但是,远期的结果仍未知晓。对于大多数患者(包括BRCA突变携带者),不建议常规使用铂类药物作为TNBC新辅助治疗的一部分,但是在一些选择性患者(如需要达到更好局部控制的患者)中可以考虑使用铂类药物。不建议在辅助治疗背景下使用铂类药物。如果基于蒽环类药物的治疗方案中包含铂类药物,化疗的最佳序贯顺序和紫杉类药物的选择尚未确立。! {5 T# {: ?4 i9 j4 B$ g6 T# O$ }
' p0 o- J) l' E
BINV-L,2/6
1 d, ~1 o- G% t- W) hHer-2阳性乳腺癌术前/辅助治疗方案
o$ p2 F5 c( u$ T. h
5 `1 s& \: d3 I3 f: D5 Y
 3 e0 o) ]/ f1 [6 t" Y U/ Y2 Y
3 e0 o) ]/ f1 [6 t" Y U/ Y2 Y
! @/ J- M% e- v% i) e0 }
脚注:4 R4 B4 O9 G; M
a.回顾性证据表明,以蒽环类为基础的化疗方案在HER2阳性肿瘤患者中可能优于非蒽环类为基础的方案。9 H+ W5 |7 @& I0 K6 K( f8 Z; S) H
b.随机临床试验表明,将紫杉类加入基于蒽环类的化疗方案改善治疗结果。
8 g7 Z. u' C0 h P8 k$ N9 [+ o% J( Mc.CMF和放射治疗可以同步给予,也可先给予CMF。所有其它化疗方案应在放疗前给予。
& l( M; b5 }+ v1 W( T% }# V( N* b6 id.化疗和内分泌治疗联合进行辅助治疗时应按照先化疗后内分泌治疗的顺序进行。# {2 ^6 V! Y: b3 a8 b0 x$ \
e.由于医疗上需要(如存在过敏反应)时,白蛋白结合型紫杉醇可以替代紫杉醇或多西他赛。如果代替每周一次的紫杉醇或多西他赛,那么每周一次的白蛋白结合型紫杉醇剂量不应超过125 mg/m2。
! p; w/ J8 K6 f X+ R W5 Tf.考虑头皮冷却,以降低接受化疗的患者因化疗引起脱发的发生率。含蒽环类药物的方案效果可能较差。0 \* K1 G- @/ g4 ~: x6 s) @3 B
k.FDA批准的生物类似药适合用于替代曲妥珠单抗。
5 k! L% Z W* X' A* r+ y7 R4 }l.曲妥珠单抗和透明质酸酶-OYSK皮下注射液(Trastuzumab and Hyaluronidase-oysk,商品名Herceptin Hylecta)可替代曲妥珠单抗。与静脉使用曲妥珠单抗相比,它的给药剂量和用药说明不同。不要用曲妥珠单抗和透明质酸酶-OYSK皮下注射液代替ado trastuzumab emtansine。9 N- Q3 W# H( L9 B2 S6 B
m.曲妥珠单抗与蒽环类药物联合使用时会引起严重的心脏毒性。应避免将曲妥珠单抗和帕妥珠单抗与蒽环类同时使用。' d% N% t! ^' Y, q! w: p
n.低危T1N0M0、HER2阳性患者,尤其是由于合并症而不符合其它标准辅助治疗方案条件的患者,可考虑紫杉醇+曲妥珠单抗治疗。% M$ Q( W* R& l
o.对于HR阳性,HER-2阳性并且认为有高复发风险的乳腺癌患者,在接受含曲妥珠单抗方案的辅助治疗后,可考虑予来那替尼(neratinib)延长辅助治疗。对曾接受过帕妥珠单抗或曲妥珠单抗抗体-药物偶联物(ado-trastuzumab emtansine)治疗的患者,接受来那替尼延长辅助治疗的益处或毒性尚不清楚。% @7 k3 c! j J5 d9 v
p.Ado-trastuzumab emtansine 3.6 mg/kg,每21天为一个周期×14周期。von Minckwitz G, Huang C, Mano M, et al. Trastuzumab emtansine for residual invasive HER2-positive breast cancer. N Engl J Med 2019;380:617-628.8 p# M7 w( `, l" l* p
1 m: Y' I, U5 @8 SBINV-L,3/67 I( D1 c" e/ J% Q0 n/ V
Her-2阴性乳腺癌术前/辅助治疗方案的给药计划# E& _$ }: V$ n
* C! f( X4 Y( D2 C7 L6 |
 8 X, H9 x1 E: k) ]2 P! p
8 X, H9 x1 E: k) ]2 P! p 2 B4 B0 l$ }( ^9 Z; ~
脚注:
' B" `- ^8 y4 N, jq.所有周期均给予髓系生长因子支持,见NCCN造血生长因子指南。+ E$ Y' x2 V" J- H
7 e/ Q" i. F* D9 B7 M. H; A抗癌药物的选择、剂量和应用以及相关毒性的处理很复杂。由于预期毒性和患者个体的差异、既往治疗和合并症的原因,经常需要调整用药剂量和方案以及启用支持治疗。因此,最佳地给予抗癌药物治疗需要一支在应用抗癌药和处理相关毒性方面具有丰富经验的医疗团队。
2 s, Z* B8 O* b7 n
! C4 H7 z Q1 D! kBINV-L,4/6
( I9 h. J7 i/ @Her-2阳性乳腺癌术前/辅助治疗首选方案的给药计划) u# j. `1 K3 O2 ?3 K# _8 k
$ u S/ B+ \% A# e8 ~
 7 B8 C2 \: U2 t, H) s) z$ h, u
7 B8 C2 \: U2 t, H) s) z$ h, u
, I% o: X* X7 n: n" s脚注:9 T( K# e$ E/ h: g" b! u7 ?
k.FDA批准的生物类似药适合用于替代曲妥珠单抗。9 z; E9 ~' K @; p+ |% V% a% Q
l.曲妥珠单抗和透明质酸酶-OYSK皮下注射液(Trastuzumab and Hyaluronidase-oysk,商品名Herceptin Hylecta)可替代曲妥珠单抗。与静脉使用曲妥珠单抗相比,它的给药剂量和用药说明不同。不要用曲妥珠单抗和透明质酸酶-OYSK皮下注射液代替ado trastuzumab emtansine。/ P9 Q# h' E2 h: t; O
q.所有周期均给予髓系生长因子支持,见NCCN造血生长因子指南。% V. l: W; c4 T3 d& R& \7 ]
r.在治疗前和治疗期间评估左心室射血分数(LVEF)。在辅助曲妥珠单抗治疗期间,评估LVEF的最佳频率尚不清楚。FDA标签推荐在开始曲妥珠单抗治疗前测量以及在治疗期间每3个月测量一次LVEF。* m _* m2 \& ?
6 E3 T# H" l6 M OBINV-L,5/6
- A" N/ U& m' L6 @Her-2阳性乳腺癌术前/辅助治疗其它方案的给药计划
" T* ~; t/ n' u' O9 z
) k4 j! p3 O+ _1 _- ^% L
 , F1 c) \3 \, m
, F1 c) \3 \, m
, z& r3 o7 t( ]3 m脚注:
" B, o1 U1 A3 X3 wk.FDA批准的生物类似药适合用于替代曲妥珠单抗。
: w. Z8 a; p# \. R# ^2 wl.曲妥珠单抗和透明质酸酶-OYSK皮下注射液(Trastuzumab and Hyaluronidase-oysk,商品名Herceptin Hylecta)可替代曲妥珠单抗。与静脉使用曲妥珠单抗相比,它的给药剂量和用药说明不同。不要用曲妥珠单抗和透明质酸酶-OYSK皮下注射液代替ado trastuzumab emtansine。/ b+ Q0 F0 @) Y8 p
r.在治疗前和治疗期间评估左心室射血分数(LVEF)。在辅助曲妥珠单抗治疗期间,评估LVEF的最佳频率尚不清楚。FDA标签推荐在开始曲妥珠单抗治疗前测量以及在治疗期间每3个月测量一次LVEF。; O1 { S6 d' Y
. l& E/ q* ^8 A* { X! cBINV-L,6/6! b2 `* t: v$ s; ]- N d% J. \; t j
参考文献; X6 }% ]8 m. n( y) m2 e* L& y
* l/ i9 M" B u
 7 Y! m8 e4 [) D( k2 s m: z$ Z" B
7 Y! m8 e4 [) D( k2 s m: z$ Z" B
________________________________________
7 |' ?9 O$ A ]- ^
( [$ |: o" {9 |3 q) u) a$ P" C术前全身治疗原则(BINV-M); _$ R3 {1 V$ d# Y. z$ ]( q
9 Y, b% T b4 H. e: I/ i
BINV-M,1/2
* U1 A- J& p) E# h' x+ f
6 x' Z, a" {6 p术前全身治疗的已知益处
" b- ^0 K$ ~2 n0 s( I●有利于保乳. h& a% v1 E- B, L6 y2 \
●可将不可切除的肿瘤变成可切除6 R5 o" S3 p( y: ]1 Q& I
●基于观察对治疗的反应,对每个患者个体(特别是三阴乳腺癌和HER2阳性乳腺癌)提供重要的预后信息& y: } C' z( }) V4 {- u
●可以在有残留病灶的HER2阳性和三阴乳腺癌患者中修改或添加辅助治疗方案
. Y9 A, v: J: i& G●可以有时间进行基因检测
! o- m5 v0 F9 A●对于选择接受乳房切除术的患者可以有时间计划乳房重建方案6 r! R( ~* x! e, h. D3 X3 Z% i
# B1 A5 n/ [8 ^4 X( K4 a' B机会
/ g8 \% @# d! t●如果治疗后腋窝淋巴结从阳性转为阴性,可能允许进行单纯的前哨淋巴结活检
3 t* C, {2 X+ ~: X# g) g& ^! l2 n●如果肿瘤对术前治疗没有缓解或进展,可以有机会调整全身治疗的方案% ^; K7 i* T; B$ q# X
●可以缩小照射野或减少腋窝淋巴结转阴病灶的放疗
1 B+ N1 m5 a E- c* M6 ]2 e●观察新治疗手段或预测性生物标志物的优秀科研平台
/ {* c0 {+ U/ j- |6 l) E ' C' ]" G) Z/ ^2 H: m
注意事项, B/ m! Z4 D& O8 f5 I, _
●如果临床分期被高估,可能导致过度全身治疗6 Y& Z* {$ C9 B4 d( \: B% V4 h
●如果临床分期被低估,可能导致放疗局部治疗不足
5 D; T2 Z4 P, t●术前全身治疗期间可能出现肿瘤进展1 C( C; ~% [/ u) z! ~: C
' [# T! }4 M- i$ z6 U3 v
术前全身治疗的适应症 k% w% b+ ]0 V' Z# R+ `+ K0 k
●不能手术的乳腺癌患者
, C5 d7 M# K2 U►非炎性乳癌
& z3 G4 b; B& I5 G- M" a% s►体积大、粘连不清的N2腋窝淋巴结转移$ U0 [& o" F6 ^- _) y8 S8 k
►N3淋巴结转移
8 j; g Y$ t- b►T4肿瘤
. ?8 Z7 t D7 S. c3 w6 r●对于可手术的乳腺癌患者,术前系统性治疗首选用于以下患者:6 B+ R+ Z; m2 [+ ]0 k/ q3 m2 f
►HER-2阳性乳腺癌和三阴乳腺癌,如果T≥2或N≥12 p [2 V1 ]9 B& Y6 g
►原发肿瘤大(相对与乳房大小)、渴望保乳的患者9 b! T( H0 `; f* p; i6 A& D) D
►淋巴结阳性,通过术前系统性治疗淋巴结可能转阴的患者
2 Z( X9 B3 i7 ]1 q4 B3 R. ^►如果需要时间来决定手术选择
. \/ L( m* h: y Y# n8 K
/ N, n; ]9 ^' }# k' y: B8 ?! U不适合接受术前全身治疗的乳腺癌
! t; e+ }0 s: }9 p D●广泛导管内癌成分,浸润癌的范围不清; `+ _. O2 z \4 s" N+ b
●术前肿瘤的范围难于界定
( O+ |4 S- y% }. g" T●肿瘤不可触及或不可通过临床评估2 ~& C9 C/ s* `/ H% ^ i
8 I8 O: W4 P* J2 y1 ]BINV-M,2/2/ l8 O5 z1 f# M" L/ W% R
术前全身治疗原则
3 P5 D! q5 |" h0 R6 q. X/ }& Q- C# T! B/ l# c
●化疗随机试验表明:对比术后接受治疗,当术前接受同样的治疗时,远期的疗效相似。1
; }! c; I5 X/ O9 P! V0 m3 P●术前全身治疗可使外科不可手术的肿瘤变成可行,并为可切除的乳腺癌患者带来潜在获益。重要的是,术前全身治疗可以提高保乳治疗的入组率,可最小化腋窝手术的范围,并提供观察患者个体对全身治疗的临床和病理反应的机会。
5 w9 v- l" ^1 S( M5 c●术前全身治疗后的病理完全缓解(pCR)与非常良好的无瘤生存期和总生存期相关,特别是所有治疗在术前给予的情况下。病理缓解和长期预后之间的相关性在三阴乳腺癌(TNBC)中最高,在HER2 +乳腺癌中低一些,在ER +乳腺癌中最低。2,3
* R' G6 `- S- |) ?0 _) X●许多化疗方案在术前给药情况下有效。一般来说,那些在辅助治疗中推荐的化疗方案可以在术前治疗中考虑。参见术前/辅助治疗方案(BINV-L)。
8 i+ F. E5 }" u" }7 _●术前单独内分泌治疗可考虑用于存在合并症或生物学特征低风险Luminal型的ER阳性乳腺癌患者。& Z" f5 f# ?+ I
●HER2阳性乳腺癌的患者应接受合并使用曲妥珠单抗的术前系统性治疗。a含有帕妥珠单抗的方案可以在≥T2或≥N1,HER2-阳性的早期乳腺癌患者中术前给药。参见术前/辅助治疗方案(BINV-L)。
2 H4 U7 q$ Y/ T( U8 y6 I% C●一些研究表明,术前化疗后局部-区域淋巴结复发的风险增加。4分析其原因,包括使用非标准的化疗方案、未使用靶向治疗、未使用现代的成像技术,还有一些使用非标准的局部-区域淋巴结管理方案。应注意遵循BINV-12和BINV-14中概述的流程,以确保接受适当的局部-区域淋巴结管理。并非所有患者都适合进行术前全身治疗。在开始术前全身治疗之前,进行准确的基线临床分期至关重要。参见术前全身治疗:乳房和腋窝评估(BINV-12)。
, B9 k, E1 c/ b●在接受术前治疗期间,应通过临床体检和影像学检查(见“BINV-13”中的脚注tt)常规评估肿瘤对治疗的反应。优选在手术前接受完整的标准方案治疗。如果在手术前未完成所有计划进行的治疗,则可在手术后接受额外的化疗以完成治疗方案。在术前全身治疗期间出现肿瘤进展的可手术乳腺癌患者可考虑换药全身治疗或立即进行手术。局部治疗原则应与接受全身辅助治疗的患者采取相同的方式。+ Z0 v1 q: Y9 H* i$ ?
# W! z- [- V: _1 {7 J8 e脚注:
/ D$ T! a# r4 U5 ~% x Y% [a.FDA批准的生物类似药适合用于替代曲妥珠单抗。
- m5 I, K/ L/ s% _$ ~1.Rastogi P, Anderson SJ, Bear HD, et al. Preoperative chemotherapy: updates of National Surgical Adjuvant Breast and Bowel Project Protocols B-18 and B-27. J Clin Oncol 2008 Feb 10;26(5):778-85./ I" k# d, k8 t7 N* N! ^% T
2.von Minckwitz G, Untch M, Blohmer JU, et al. Definition and impact of pathologic complete response on prognosis after neoadjuvant chemotherapy in various intrinsic breast cancer subtypes. J Clin Oncol 2012 May 20;30(15):1796-804.
5 t5 ^% I0 L2 s; S3.Cortazar P, Zhang L, Untch M, et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet 2014 Jul 12;384(9938):164-72., Z" c5 ?% D/ h# V" w7 w
4.Long-term outcomes for neoadjuvant versus adjuvant chemotherapy in early breast cancer: metaanalysis of individual patient data from ten randomised trials. Lancet Oncol 2018;19:27-39.# [1 h& P: x3 N
________________________________________/ M+ z b& W7 F8 J: T$ @
; E( j0 f% q& V1 W
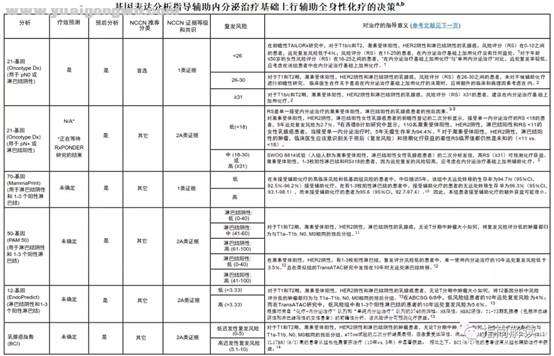
基因表达分析指导辅助内分泌治疗基础上行辅助全身性化疗的决策(BINV-N)
8 F+ G- ]3 ?# U6 g) Y # a" F/ e) q0 x* J" _1 g/ l9 n
BINV-N,1/2, x2 B# t3 n' r: e" O9 W
& X' v( Z* ~5 ~0 Y: r3 N
 ( O+ H0 \6 u' B1 ^4 `- G9 p
( O+ H0 \6 u' B1 ^4 `- G9 p
e7 h/ K& e6 Y3 Q+ n% f脚注:
6 W, W& j Z/ E/ E. c2 Ua.基因表达分析提供预后信息和治疗疗效预测性信息,补充了T,N,M和生物标志物信息。分期不需要使用这些检测方法。对于淋巴结转移阴性的乳腺癌,NCCN乳腺癌专家组首选推荐行21基因分析(Oncotype Dx)。其它预后性基因表达分析可以为1-3个阳性淋巴结的患者提供额外的预后信息,但是在预测有1-3个阳性淋巴结的患者是否能够从化疗获益中的价值尚不清楚。0 n, Z. \7 l2 | C! N
b.参见男性乳腺癌的特别注意事项(BINV-J)。# k% s& @# F; q% q
4 I2 ^% E$ b" v6 }. j4 h6 Y/ v
BINV-N,2/28 }3 o* X- G4 D; P
参考文献7 c5 E8 X6 S" ]* f6 |% \
3 P, K0 c( e. \
 % t. H0 v$ w3 [' k) A4 W, {
% t. H0 v$ w3 [' k) A4 W, {
# {: W1 A ?, _+ b& X) U5 T* t
; a" T7 r( b! L6 a; |2 U2 h$ l
, \8 j U, ^' u) q/ k; S2 N
 8 @7 M( H, }5 M" G0 m, {
8 @7 M( H, }5 M" G0 m, {
L: k# ?5 @ E( {$ Y$ c绝经的定义(BINV-O)
7 Y1 m: K! z1 y, K+ B
# y G# K0 D+ s不同的乳腺癌临床试验采用的绝经定义不尽相同。绝经一般是指月经永久性终止,也用于描述乳腺癌治疗过程中卵巢合成雌激素永久性严重减少。可用于确定绝经的合理标准,包括以下中的任意一条:1 Y2 L& d) l4 K( h, T
●先前接受过双侧卵巢切除术: ^0 _8 e& k: I; c% @
●年龄≥60岁' g( A, s5 w$ b. X
●年龄<60岁,且在没有化疗和服用他莫昔芬、托瑞米芬和卵巢功能抑制治疗的情况下停经12个月或更长时间,同时卵泡刺激素(FSH)及雌二醇水平处于绝经后的范围
( w( E& I2 X( _9 g! Q0 p●如果服用他莫昔芬或托瑞米芬且年龄<60岁,则FSH及血浆雌二醇水平必须处于绝经后的范围。- _& h) {! T; K' H1 K
/ Q& W' u {3 [* K7 i正在接受LHRH激动剂或拮抗剂治疗的妇女,无法评估是否处于绝经状态。辅助化疗之初没有绝经的妇女,停经不能作为判断绝经的依据,因为患者在化疗后虽然会停止排卵或停经,但卵巢功能仍可能正常或有恢复可能。对于那些治疗诱发停经的妇女,如果考虑采用芳香化酶抑制剂作为内分泌治疗的一部分,需要通过卵巢切除术或者连续多次监测FSH和/或雌二醇水平来确认患者处于绝经后状态。
# i6 [! i9 Y) V. p) {8 }________________________________________
) t5 n3 p6 f" [+ N 8 X* x7 Q! ~$ }5 d" R% ?
ER和/或PR阳性乳腺癌复发或IV期乳腺癌的全身治疗(BINV-P)
7 a7 a5 a( {9 X, ?) ? : \& q6 w7 i9 W" \( m+ s, a. w' \4 a
 ; v* r+ Z- d6 ?# `9 t
; v* r+ Z- d6 ?# `9 t
" V1 M$ O1 P* Z) J脚注:
- u6 r! A- k# s$ t# da.如果在接受CDK4/6抑制剂治疗期间出现疾病进展,没有数据支持采用另一种含CDK4/6的方案进行下一线治疗。同样,如果在接受含依维莫司的方案中出现疾病进展,没有数据支持采用另一种含依维莫司的方案进行下一线治疗。
9 F, h7 N$ [, W4 W2 Xb.单一研究(S0226)显示,先前没有接受过化疗、生物治疗或内分泌治疗的激素受体阳性转移性乳腺癌女性患者,阿那曲唑额外添加入氟维司群可延长至疾病出现进展的时间和总生存期。亚组分析表明,先前未接受过他莫昔芬辅助治疗和距离初诊时间超过10年的患者获益最大。设计类似的两项研究(FACT和SOFEA)显示在疾病进展时间方面阿那曲唑额外添加氟维司群没有优势。, B, i0 e9 x: g3 e' W, o7 ]- O
c.参见复发或IV期(M1)乳腺癌的附加靶向治疗和相关生物标志物检测(BINV-R)。
& a' h Y7 j" |5 R, H% \d.用于远处转移情况下先前接受内分泌治疗和先前接受化疗出现进展后。4 d+ l$ m: M! h
e.符合BOLERO-2标准的患者(12个月内出现进展,或使用非甾体类芳香化酶抑制剂时出现进展) ,可考虑依西美坦与依维莫司联合用药。
. _' Q$ w8 e7 _5 P4 Z9 H* d# af.FDA批准的生物类似药适合用于替代曲妥珠单抗。
( a8 H) I% g% |. ]8 s8 Jg.曲妥珠单抗和透明质酸酶-OYSK皮下注射液(Trastuzumab and Hyaluronidase-oysk,商品名Herceptin Hylecta)可替代曲妥珠单抗。与静脉使用曲妥珠单抗相比,它的给药剂量和用药说明不同。不要用曲妥珠单抗和透明质酸酶-OYSK皮下注射液代替ado trastuzumab emtansine。9 ~% j' Q/ B3 L0 ~
h.如果初始时用“化疗+曲妥珠单抗+帕妥珠单抗”治疗,并且化疗已经停止,可以在“曲妥珠单抗+帕妥珠单抗”治疗中加入内分泌治疗。
7 z9 ]( ]( {! t6 {/ a& x________________________________________
7 G: z2 T( r5 [* {, N! P/ X) x- Z . _% N/ H0 ~" `1 j* v
复发或IV期(M1)乳腺癌的全身治疗方案(BINV-Q)0 s8 ]9 X$ f2 W0 a, T( X/ {: c7 f
5 A4 Y" @. R0 b0 _3 ~! DBINV-Q,1/66 h [/ u; Q4 R! ^$ s
复发或IV期乳腺癌的系统性治疗方案1 {) W/ Y2 M! @/ w j4 `' }0 b$ U
8 p& d' T5 e. b$ W f
 " j, n) N9 Y8 m& {- f) K
" j, n) N9 Y8 m& {- f) K
x! H8 E5 ]" h
脚注:* L; z3 b$ @3 O9 v2 b+ F
a.由于医疗上需要(如存在过敏反应)时,白蛋白结合型紫杉醇可以替代紫杉醇或多西他赛。如果代替每周一次的紫杉醇或多西他赛,那么每周一次的白蛋白结合型紫杉醇剂量不应超过125 mg/m2。
2 }, r$ D! r% T4 lb.考虑头皮冷却,以降低接受化疗的患者因化疗引起脱发的发生率。含蒽环类药物的方案效果可能较差。
, B6 ^1 q8 h" p" G+ Lc.有关脑转移的治疗,参见NCCN中枢神经系统肿瘤指南。& Y$ ?" Z# e% F: P7 u: D0 Q3 D" W/ t- M; ^
d.对于所有复发或转移性乳腺癌患者,评估胚系BRCA1/2突变,以识别适合接受PARP抑制剂治疗的候选者。
5 S$ Q# r+ N) ?5 a+ G2 a$ r1 a& pe.见复发或IV期(M1)乳腺癌的附加靶向治疗和相关生物标志物检测(BINV-R)。" b- U5 b/ B+ E3 p% L
f.首选序贯单药,但化疗联合方案可能用于一些肿瘤负荷高、疾病迅速进展和存在内脏危象的选择性患者。9 O2 ~2 k1 r0 l# K/ ~- c5 S0 w* O
g.有关转移性乳腺癌的随机临床试验表明,贝伐珠单抗添加至某些一线或二线化疗方案略微改善至疾病进展时间和缓解率,但并未延长总生存期。对至疾病进展时间的影响可能因细胞毒药物的不同而不同,似乎“贝伐珠单抗联用每周紫杉醇”影响最大。
- Z. m+ {. n! P; Kh.FDA批准的生物类似药适合用于替代曲妥珠单抗。
) j4 s k& \' x0 P% ]i.曲妥珠单抗和透明质酸酶-OYSK皮下注射液(Trastuzumab and Hyaluronidase-oysk,商品名Herceptin Hylecta)可替代曲妥珠单抗。与静脉使用曲妥珠单抗相比,它的给药剂量和用药说明不同。不要用曲妥珠单抗和透明质酸酶-OYSK皮下注射液代替ado trastuzumab emtansine。
* J1 C' E$ I# ?' ^2 ij.患者如果既往已使用化疗加曲妥珠单抗治疗但没有用过帕妥珠单抗,可考虑采用某一线包括曲妥珠单抗加帕妥珠单抗的治疗,可合并也可不合并细胞毒药物治疗(如长春瑞滨或紫杉类)。确定抗HER2治疗理想的顺序策略还需要进一步研究。
$ c2 p/ [& X. J8 Q# W* L+ a+ Nk.曲妥珠单抗与蒽环类药物联合使用时可引起严重的心脏毒性。应避免将曲妥珠单抗和帕妥珠单抗与蒽环类同时使用。6 E( }3 a. Z4 f9 g! J
l.曲妥珠单抗可以安全地与上面列出的用于复发性或转移性乳腺癌的包含首选和其它单一方案的所有非蒽环类药物联用。2 h" Y9 t3 w; f4 K, {+ q* x
% @3 V8 E2 e! d' ^% _BINV-Q,2/6
3 U! A0 H5 p* Y6 A$ P8 Q/ c* C" a3 QHer2阴性乳腺癌系统性治疗方案的给药计划/ I3 H7 i0 C( S
) M# B! C; T. F& N2 h
 , P0 f- X8 y8 K6 N, I0 G
, P0 f- X8 y8 K6 N, I0 G 4 ]( ] F4 f* ~" }7 q. q) M, ?
抗癌药物的选择、剂量和应用以及相关毒性的处理很复杂。由于预期毒性和患者个体的差异、既往治疗和合并症的原因,经常需要调整用药剂量和方案以及启用支持治疗。因此,最佳地给予抗癌药物治疗需要一支在应用抗癌药和处理相关毒性方面具有丰富经验的医疗团队。
: g) K8 u- y6 ? e7 `9 n ) y+ z) ~# r* a v4 ^6 P
BINV-Q,3/6
0 G1 I" B" _; j" c' J! D6 W6 aHer2阳性乳腺癌首选系统性治疗方案的给药计划
5 c/ {- D7 F' H, g: i6 {: _
7 Y+ x" h- L7 \) d. o8 c
 , ^# m+ n- `5 s& W! h+ {* D
, ^# m+ n- `5 s& W! h+ {* D
1 I* @0 o4 H' q$ L* C8 A
抗癌药物的选择、剂量和应用以及相关毒性的处理很复杂。由于预期毒性和患者个体差异、既往治疗和合并症的存在,经常有必要改变用药剂量和方案以及启用支持治疗。因此,最佳地给予抗癌药物治疗需要一支在应用抗癌药和处理相关毒性方面具有丰富经验的医疗团队。7 @8 I$ a- Q% \# s4 u
5 f8 }/ Q2 a' t) ^
BINV-Q,4/6
2 C* c3 Q' g/ A& S4 UHer2阳性乳腺癌其它系统性治疗方案的给药计划# ?$ W: n9 ]( X; K+ o w7 t) L6 L R
3 X0 Y0 K9 O2 U& V F" K6 m
 : X/ ^9 _4 i5 d0 e2 O
: X/ ^9 _4 i5 d0 e2 O
4 f: e. K( W0 F* z% j/ `
抗癌药物的选择、剂量和应用以及相关毒性的处理很复杂。由于预期毒性和患者个体的差异、既往治疗和合并症的原因,经常需要调整用药剂量和方案以及启用支持治疗。因此,最佳地给予抗癌药物治疗需要一支在应用抗癌药和处理相关毒性方面具有丰富经验的医疗团队。
9 v# S: E- G- F
; r4 }6 U! J: uBINV-Q,5/6
) m v/ g5 i- m- Z4 Z! D& {参考文献1~27
" U* U, v7 {: [$ T
4 b9 i$ ?8 I$ i6 Z2 F' ^
 0 e* E0 e$ v% C3 j, O
0 e* E0 e$ v% C3 j, O 1 F* x6 J8 D! y, I4 q2 D- b
BINV-Q,6/6" j4 F4 o6 D0 u
参考文献28~51. c7 P. w: Y4 j+ P) Z Q2 A8 b4 s
; ?! r( O5 R) [1 G0 f! A1 a8 N
 9 q- k, W7 h( ~% e/ k
9 q- k, W7 h( ~% e/ k ________________________________________' y: G5 m. b3 c1 ]8 q8 X' L; z+ Y& n( e
# ~" _- H8 v+ i
复发或IV期(M1)乳腺癌的附加靶向治疗和相关生物标志物检测(BINV-R)8 E0 s4 Z: h0 } V2 H% `8 n
, \7 |( T# Q! U- G
BINV-R,1/3: @) _) b9 @+ F* w
与FDA批准的治疗相关的生物标志物
$ k' Z8 l3 `$ V4 g" P, Q7 V! P9 P/ F+ Q& K1 h' {
 8 A5 ?% A; |& ^; H6 w
8 A5 ?% A; |& ^; H6 w
# L e. o8 u3 F& q# \脚注:
' K H8 e+ p1 x- S( ?a.对于所有复发或转移性乳腺癌患者,评估胚系BRCA1/2突变,以识别适合接受PARP抑制剂治疗的候选者。FDA批准奥拉帕利和Talazoparib用于治疗携带BRCA1/2胚系突变的HER2阴性乳腺癌,指南专家组支持它们用于与胚系BRCA1或BRCA2突变相关的所有乳腺癌亚型。* | C( K _ i" g1 i
b.对于HR阳性/HER2阴性的乳腺癌,如果考虑行“Alpelisib+氟维司群”治疗,应通过肿瘤或液体活检评估PIK3CA突变以识别适合接受该联合治疗的候选者。PIK3CA突变可用肿瘤组织或外周血中的ctDNA(液体活检)进行检测。如果液体活检阴性,建议用肿瘤组织进行检测。
" U' U/ K/ L# qc.对于三阴乳腺癌,评估肿瘤浸润免疫细胞上PD-L1表达的生物标志物状态,以识别适合接受“阿特珠单抗+白蛋白结合型紫杉醇”治疗 的候选者。4 j1 `+ i! A. F) K( r1 o5 `
d.Alpelisib在1型糖尿病或未受控制的2型糖尿病患者中的安全性尚未确立。
; ?! G! g: @% I3 L" Oe.拉罗替尼和恩曲替尼适用于治疗携带NTRK基因融合但无已知获得性耐药突变且没有令人满意的其它疗法或在治疗后进展的实体瘤。: l3 _! r+ }% E$ p$ {
f.帕博丽珠单抗适用于治疗存在高水平微卫星不稳定性(MSI-H)或错配修复缺陷(dMMR)的无法切除或转移性实体瘤患者,这些患者在先前的治疗后进展且没有令人满意的其它治疗选择。8 G" I$ d% R2 [2 C
3 H) s" v* U3 T: w n( b
BINV-R,2/3+ O# R, ]+ j o8 f" ?/ @: n. C% Z
附加靶向治疗方案的给药计划" G. _9 g+ Q/ z8 E) y
2 j3 V& ~- @) n+ F2 ~. _6 C
 / @1 s. c( j( S7 ]1 i/ l0 g. ?
/ @1 s. c( j( S7 ]1 i/ l0 g. ? 4 Y# z* Q8 M1 o+ r: M# I
脚注:, z, P J: }8 [8 D
g.也有胶囊制剂。但是,由于剂量和生物利用度的差异,请勿以mg/mg为基础将胶囊替换为片剂。9 W' O; i9 ]8 K1 O
& Z* S1 O( E0 \0 cBINV-R,3/3
5 @2 u% y' a% k8 o; {! O, B参考文献" v4 V- B1 D- S
3 q3 L6 D7 ?, z+ B* d, ?6 F$ `$ Z
 : @( h |4 O( `, u2 L7 L. o$ p
: @( h |4 O( `, u2 L7 L. o$ p ________________________________________
: R" Z, P5 D: S2 M: L; v
0 e( P' |/ ]! w1 }* e远处转移乳腺癌的监测原则(BINV-S)
& M E8 v1 A/ W2 ? q" y: G' M. Y2 i
- V* \/ c) b! D K {; dBINV-S,1/3& }) R: E0 R2 r
% Z: f% J( _5 @, T! q患者症状和癌症负荷的监测在转移性乳腺癌治疗期间非常重要,可用以确定治疗是否提供获益以及患者未因无效治疗产生毒性反应。
% H2 A( g/ p+ J2 g; T
, r8 q) F$ Y4 [1 ^/ K; R# N9 p监测的组成部分:" ] N* \& \' {+ \; j
转移性乳腺癌的监测包括对症状的各种组合、体检、常规实验室检测、影像学检查以及适当情况下的血液生物标记物进行评估。监测的结果被分类为:对治疗的反应缓解/持续缓解、病情稳定、有关疾病状况不确定或疾病进展。临床医生通常必须评估和平衡多种不同形式的信息,以作出有关病情是否被控制以及治疗的毒性是否可以接受的判断。有时,这些信息可能相互矛盾。临床医生应通过一个共同决策的过程考虑到患者的偏好选择。
5 v% D! b5 j; V* u
' T3 p4 ]* h0 s: S7 a疾病进展的定义:
5 q( `9 T+ Q3 t& r- v确定疾病进展需要一个或多个这些因素提供的疾病进展的明确证据,疾病进展的原因可能是因治疗效果不佳,也可能是因为疾病产生了对治疗的抗性。疾病进展可通过已知病变部位病灶扩大或恶化和/或在新的部位出现转移病灶的证据来确认。6 T4 d6 e! q1 p9 U% i, T
●有关疾病进展的监测结果包括:
( o: V h: q% q! y4 v1 F►疼痛或呼吸困难等症状恶化& {+ f, r& n$ v
►体检时发现恶化或新发病变的证据
, |& e1 f6 r$ @- h►体能状态不断下降
* ~ X( @; ?; i% m0 L+ C6 G►不明原因的体重下降
* h6 t3 n" h) Q►碱性磷酸酶、ALT、AST或胆红素升高
# R" n" ~+ f1 t: Q! I►高钙血症! _+ V& e- Z) y
►出现新的放射影像异常或已有放射影像异常大小增加
6 |, i: `% ]& ~, G$ L5 l& b►功能影像学检查(例如骨扫描、PET/CT)发现新的异常部位
8 m! Y5 T/ X5 s; L$ j, G►肿瘤标记物(例如CEA、CA15-3、CA27.29)升高a* h% E. c% ], c4 }$ `$ \
2 [& O! v0 s$ u
脚注:
+ [; u! N, ], E0 o+ T fa.肿瘤标记物(如CEA、CA15-3、CA27.29)升高会担心肿瘤进展,但也可能见于疾病缓解的情况下。仅凭肿瘤标记物的增加很少能用来断言疾病进展。骨病灶的变化往往很难在平片或断层放射影像或者骨扫描上进行评估。出于这些原因,患者的症状和血清肿瘤标记物对于所患疾病以骨转移为主的患者来说可能更有帮助。8 Q, b8 @: q% H3 ^3 {. `
1 u& T3 }7 @) n2 JBINV-S,2/3
. F! H6 \, F+ G) ^0 I& ?( R. `$ V6 L' M% _
“缓解/稳定/进展”客观标准的使用:! q8 s: ~; g, q
●对疾病活动性的最准确评估,通常是通过连续、定期地重复进行先前发现异常时的检查手段来实现。一般来说,应在不同的时间使用相同的评估方法(例如胸部CT检查时发现的异常通常应通过重复进行胸部CT检查来监测)。
7 \) g% \* m/ ^●所有系列研究使用的一些非临床的重要变量都是常用的变量,也是完全在意料之中的变量。因此,鼓励使用客观以及广泛接受的缓解、稳定和疾病进展标准。这些体系包括实体瘤的疗效评价标准(RECIST)指南(Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer 2009;45:228-247)和WHO标准(Miller AB, Hoogstraten B, Staquet M, and Winkler A. Reporting results of cancer treatment.Cancer 1981;47:207-214)。; d$ y9 X* E8 `
●核素骨扫描和PET显像等功能影像学检查在用于评估疗效时尤其存在很大的问题。在骨扫描的情况下,疾病缓解可能造成闪烁或扫描上的活动性增加,可能能被误读为疾病进展,尤其是在开始新的治疗后第一次随访骨扫描时。由于缺乏重现性、验证以及广泛接受的一套疾病活动性评估标准,PET影像检查富有争议。
$ O! s# `5 k3 h; B! u% O, X4 f. n2 k
m0 C6 o8 e/ A* t: F0 s3 RBINV-S,3/3/ z% F7 z! V+ T
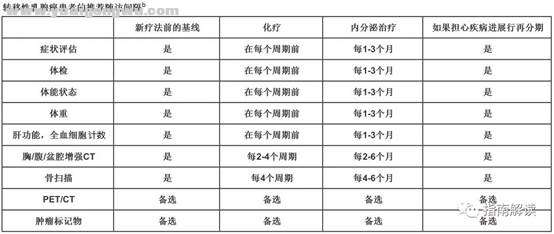
7 ^5 D7 g O: V" A7 k. G% W监测频率
% a" ?5 k3 O8 }+ k" T$ ~重复检测的最佳频率并不明确,主要基于乳房癌临床试验中运用的监测策略而定。监测的频率必须平衡各方面的需要,包括发现疾病进展、避免任何无效治疗的不必要毒性、充分利用资源和确定成本。下表旨在提供指导,应根据病变部位、疾病的生物学行为和治疗方案针对个体患者加以修改。无论距之前的检查间隔多长时间,患者有病变新发或加重迹象或有症状的都需要进行疾病活动性的重新评估。1 J7 W# X3 p( P5 X$ L
4 E6 @) I* E; \8 V
远处转移乳腺癌患者推荐的随访间隔b
: _4 R4 U# q9 U. W# r
6 }/ E4 o, n2 ~1 e$ W
 ) A+ }6 J$ ~( A8 W/ j0 p
) A+ }6 J$ ~( A8 W/ j0 p + {" L; a1 S% ^* h z/ x
脚注:
! v! i8 }, s- L4 T; F5 xb.对于疾病长期稳定的的患者,可以降低监测频率。
7 X% k3 P& v) D; I2 ]2 Q* [" h" D2 ~( I7 L: ~! n1 ]" _
$ n, a* Y/ T* ]: O
9 _6 P- J" d1 L5 _
 " l" N8 r8 `& P% t/ I1 R
" l" N8 r8 `& P% t/ I1 R
+ ^* }/ I5 K8 ~& \( d& P0 c4 U
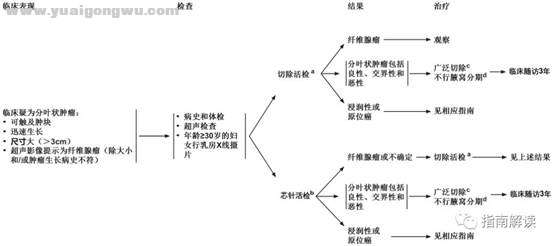
分叶状肿瘤 3 A) Q6 w; @8 j; G
9 Z0 t3 e9 M. t% fPHYLL-1
! Y# G" g5 C2 d1 v7 H& R9 D4 M" G# G- |1 G; |6 I
 A t$ j' N4 S' b+ v
A t$ j' N4 S' b+ v
4 L' w- f' W5 k5 q9 e; D/ r脚注:
; i5 }+ D8 N. s1 U1 sa.切除除活检包括肿块完全切除,但并不要求获取手术安全边距。
( o1 ~/ D9 o2 P0 Y* P- \6 k. @- xb.在某些情况下,FNA或芯针活检可能无法将纤维腺瘤与叶状肿瘤区分开。芯针活检诊断分叶状肿瘤的敏感性高于FNA活检,但芯针活检和FNA活检二者均不能区分叶状肿瘤和纤维腺瘤。对于临床怀疑分叶状肿瘤的病例,可能需要切除病灶进行明确的病理分类。
2 Z( \6 J" F5 T6 p# h& T7 ?7 wc.对于恶性和交界性疾病,广泛切除要求切除的边距≥1cm。手术切缘窄会增加局部复发风险,但是如果乳房部分切除术不能达到≥1cm的边距,也并非是全乳切除的绝对适应证。
7 W! ~% r: |; Gd.尚无前瞻性随机研究资料支持对分叶状肿瘤进行放疗。然而,如果再次复发会造成病情恶化(如全乳切除后的胸壁复发),可考虑根据软组织肉瘤治疗的相同原则进行放疗。- d7 B' Z1 i- |, }0 w& u) B
/ L# u n: j7 ~: ~' J b
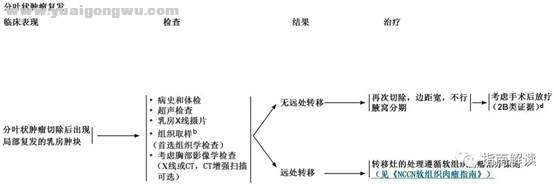
PHYLL-2
2 F6 h5 v0 L, `6 @1 r: T! I* j+ N# L+ h; k6 F
 1 r& [ y: B6 U/ b
1 r& [ y: B6 U/ b . D9 j# u' X9 ]5 A. z
脚注:
3 I& a( x+ N6 z/ g* bb.在某些情况下,FNA或芯针活检可能无法将纤维腺瘤与叶状肿瘤区分开。芯针活检诊断分叶状肿瘤的敏感性高于FNA活检,但芯针活检和FNA活检二者均不能区分叶状肿瘤和纤维腺瘤。对于临床怀疑分叶状肿瘤的病例,可能需要切除病灶进行明确的病理分类。+ }- I3 ^; x% ^6 b4 @
d.尚无前瞻性随机研究资料支持对分叶状肿瘤进行放疗。然而,如果再次复发会造成病情恶化(如全乳切除后的胸壁复发),可考虑根据软组织肉瘤治疗的相同原则进行放疗。
1 H c2 d' f* e! I" Q% H________________________________________2 X: d" h% [4 v+ C$ [
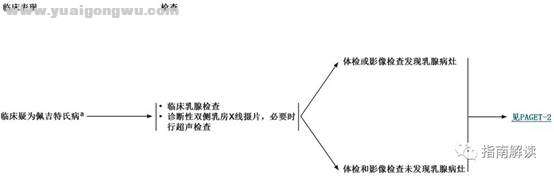
* {1 W- y4 ~+ \# p, g佩吉特氏病0 M9 [( S$ ?3 ~' e. z& Y1 u% M5 r
5 y( \! T* z ~/ l. h3 ?# |PAGET-11 q. |8 U) L3 e& z2 E9 v$ w# G
; s! D) r7 M1 A/ L9 I/ E
 / J$ I8 D j( R( Y$ V
/ J$ I8 D j( R( Y$ V 8 U/ F. f9 o- K- e. a$ z( U I
脚注:
% r5 a# V& s+ I8 i; M' Y- r4 b+ Ia.乳头或乳晕湿疹、溃疡、出血或瘙痒。/ G( V& x8 h0 E4 v; K R4 Z
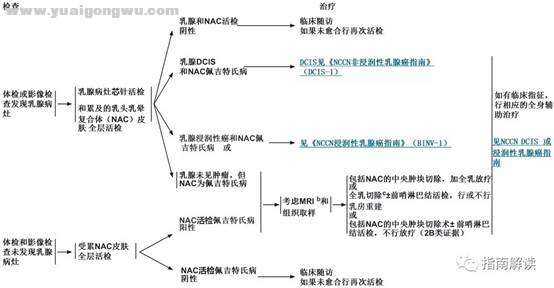
- d; |3 p% \3 L; b/ b& n; ~PAGET-2 u7 X5 W/ z" S3 [" `' u
( ?5 S4 Y, X9 |. h
 4 W+ H$ ~- G& ^( \: W
4 W+ H$ ~- G& ^( \: W
/ K# s8 `, Y* s4 T6 |% }$ y脚注:- g& \0 L& P: r9 n- H& x$ c
b.见乳腺专用MRI检查原则(BINV-B)。
- N" P4 Q- {" {0 a3 vc.有任何佩吉特氏病的表现,都可选择全乳切除(见“讨论”部分)。$ D& s+ p. [! E8 P
________________________________________
& b9 @6 K3 g0 z4 y3 A& ?# b* d3 r 2 k( k3 d2 @6 [7 Z/ X4 T
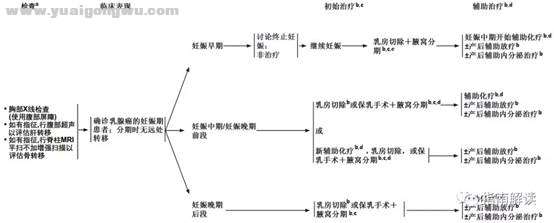
孕期乳腺癌(PREG-1)
2 l- V# C- k2 g
/ A+ {, g8 J* j, E0 y4 h
 % K/ V. l/ w) J# _2 {% Q
% K/ V. l/ w) J# _2 {% Q
4 l- w$ u& D1 m; q" Q! m脚注: l% j: ^) q& t+ z
a.CT扫描和核成像在怀孕期间是禁忌。$ V3 V# d4 o2 c0 {. f" C- |7 k& C
b.最佳局部治疗和全身治疗的考虑和选择与非妊娠相关乳腺癌的推荐类似;见本指南的其它部分。但是,妊娠期和非妊娠期患者的化疗、内分泌治疗和放疗选择和时机有所不同(见“讨论”部分)。妊娠早期不应给予化疗,在任何妊娠期都不应施行放疗。建议肿瘤科团队和产科团队之间进行协调,以计划怀孕期间进行系统性治疗的最佳时机。妊娠期乳腺癌化疗的大多数经验来自利用阿霉素、环磷酰胺和氟尿嘧啶各种组合的方案。产后化疗的考虑与非妊娠相关乳腺癌相同。0 Q# v: D# p# J, \7 X" A$ K
c.蓝色染料的使用是妊娠期的禁忌证;妊娠期将放射性标记的硫胶体用于前哨淋巴结活检妊娠貌似安全。见“外科腋窝分期”(BINV-D)。2 i" S" t$ A8 v5 R3 T
d.尚无足够的安全数据支持建议在妊娠期常规使用紫杉类。使用抗HER2治疗是妊娠期的禁忌证。' O( i- u* } J2 B. j* H
e.如果是妊娠早期后段确诊为乳腺癌,可考虑在妊娠中期行术前化疗。
9 }/ l. S( Z; R( ]1 l4 C________________________________________, g& ^5 j( m( E$ E9 { F
& a+ |* K: r4 \ V' V3 |" U% f
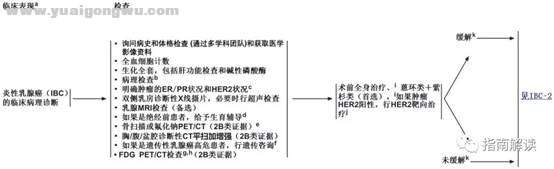
炎性乳腺癌& K& L" i( a) K8 {' V: [" p4 \0 E3 c* L
6 }: D5 S' \+ F1 x1 W+ zIBC-1
8 L& D. M$ k5 e' z+ q
$ d6 C ]3 r4 b8 r
 ! ~- m+ e. s" d! }8 ^0 R
! ~- m+ e. s" d! }8 ^0 R # I8 M( u, Q% }
脚注:' ^! K+ T0 o- P6 ?4 }+ d: J. x8 p- m
a.炎性乳腺癌是浸润性乳腺癌的一种临床综合征,特征包括乳腺1/3或以上皮肤出现充 血和水肿(橘皮征)。需与之鉴别的疾病包括乳房蜂窝织炎和乳腺炎。该病的典型病 理表现是在受累部皮肤的真皮淋巴管中见到肿瘤细胞,但这一表现并非诊断炎性乳腺癌之必要条件,也不能仅以此表现诊断该病。
- q! v5 c5 J$ X( sb.指南专家组支持所有浸润性和非浸润性乳腺癌的病理报告都遵循美国病理学家协会颁布的草案。http://www.cap.org。
& p% P* J! |' e5 o% o; Dc.见“生物标志物检测原则”(BINV-A)。$ I$ c d0 F! \& Y0 g0 P' E
d.见“生育能力和节育问题”(BINV-C)。
7 H; `8 i, B3 k" _6 Ee.如果进行了FDG PET/CT并在PET和CT部分均有骨转移的明显指征,则不需要再进行骨扫描或氟化钠PET/CT。& y8 R" l, e5 E$ G6 \
f.见《NCCN遗传/家族性高风险评估指南:乳腺和卵巢》。
& y* @4 K$ s3 ^5 V# r6 j' Pg.FDG PET/CT可与诊断性CT检查同时进行。FDG PET/CT最有助于标准分期检查难以判断或者存在疑问时的协助诊断(特别是对于局部晚期或转移性乳腺癌患者)。
7 Z9 [5 ?& j7 P9 z% eh.FDG PET/CT联合常规的分期检查方法,可能也有助于检测出局部晚期乳腺癌中未被怀疑的区域淋巴结转移和/或远处转移。; c5 |* L0 |; h$ J& v$ J5 k
i.见“术前全身治疗/辅助化疗”(BINV-L)。 `! ~/ O+ _( R$ o# j7 z/ A. X
j.HER2阳性的IBC患者可在术前给予含有帕妥珠单抗的治疗方案。$ r1 m& S. ^) n* A& V2 i7 k
k.难于准确评估乳腺肿瘤或区域淋巴结对术前全身治疗的反应,评估内容应初始肿瘤分期时体检和影像学检查(乳房X线摄片和/或乳房MRI)发现的异常表现。应由多学科团队来确定术前影像学检查方法的选择。
! k: u7 b: ]& i8 ] e* i + X3 R: R7 _/ y# ~' R% D' a9 p
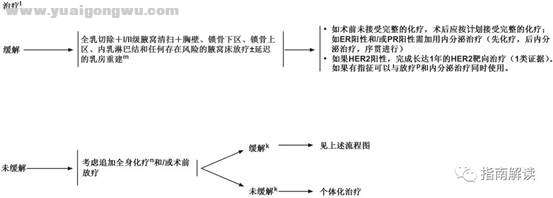
IBC-2
4 s; q; K( s2 D+ l; i# @. T5 Q
0 Y4 H5 c* a$ l( Y7 U) v: ^: ~- |
 ( Z# m$ s" ]% b! ~6 m4 X
( Z# m$ s" ]% b! ~6 m4 X ; P) E5 p8 n! C6 S; G5 g1 [* k+ h
脚注:. D* B W: o7 d7 \% R& J* ]4 w
k.难于准确评估乳腺肿瘤或区域淋巴结对术前全身治疗的反应,评估内容应初始肿瘤分期时体检和影像学检查(乳房X线摄片和/或乳房MRI)发现的异常表现。应由多学科团队来确定术前影像学检查方法的选择。
* f8 s# ~0 p$ t: R8 |4 o! pl.复发的炎性乳腺癌患者的治疗应参照复发或转移性乳腺癌的治疗(BINV-18)。 / S4 [- U# J( c& k" n7 a! E
m.见“术后乳房重建原则”(BINV-H)。
b6 t {8 p: m+ X- Ln.见“复发或IV期(M1)乳腺癌的化疗方案”(BINV-Q)。& O- u& K U; t/ G% O
o.见“辅助内分泌治疗原则”(BINV-K)。
! o( I8 U# g# n/ {p.见“放疗原则”(BINV-I)。 _/ L! X0 R3 \/ x( w4 C! z' I2 V
________________________________________
" @" K: H) V: v1 B 4 d5 u6 T( n$ C1 ?5 o4 K
分期(ST)
* y2 p" \0 }+ n % H; c& m' i# @6 N
AJCC乳腺癌分期手册第8版(2017年)* ~, x' i J, P* r' M! `
. P+ b% N2 S* F; h. bST-10 N' {$ n7 l7 c/ j! E! q3 U
T分类的定义4 B" E. S I* |, q- T- `2 n5 H; F
% `! q9 H6 c" O) k
 2 m0 j6 z, v! T" C' Z0 r4 O% q1 o
2 m0 j6 z, v! T" C' Z0 r4 O% q1 o
1 s5 y3 g% [8 s$ g3 x0 {2 Y. M& ~3 X$ zST-2$ ?) Q6 L( g- X" v$ A: v
N分类的定义
: F$ q, \, G0 b6 P, e# w0 \1 G # H$ q/ J$ m/ m5 H. d& F2 n2 n
 # r d( z" W+ b" \2 {! p# \! ]
# r d( z" W+ b" \2 {! p# \! ]
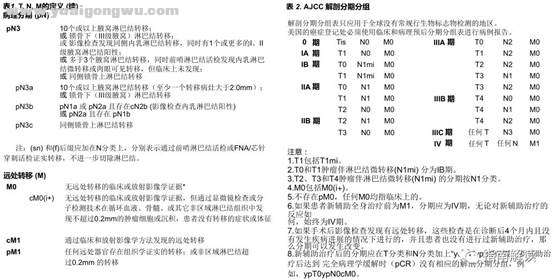
3 y! q2 i/ z: ], s" M3 O- u) WST-3# b; U) q* |1 X; g/ e6 o: p
M分类的定义和解剖分期分组6 }" l/ v: J5 g- _- @% M6 `' s
) ^) H4 S% ^5 m: a. h
 " H3 f) o* m6 d" L# [- m' c
" H3 f) o* m6 d" L# [- m' c % ]$ p! R' m7 Y! X1 \) W! M4 p
ST-4+ u* W2 k, E' v2 p+ f3 O
组织学分级和组织学类型4 D5 q4 A! {* J$ S5 n
0 l/ U' N9 q& F9 j% h. V
 8 O9 ]+ n; H0 q" K8 L" [" G5 L
8 O9 ]+ n; H0 q" K8 L" [" G5 L
; h! y" J; q. s' F4 R/ V, ^4 EST-5,6,7
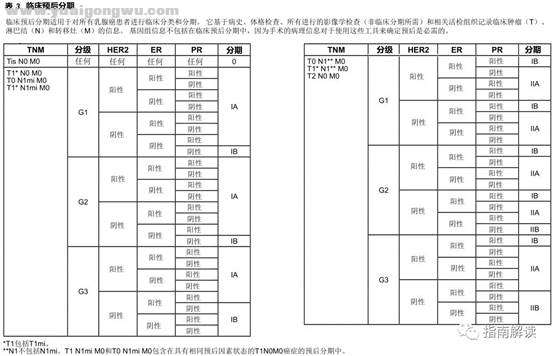
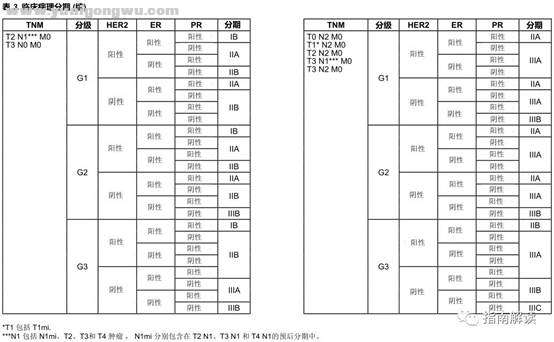
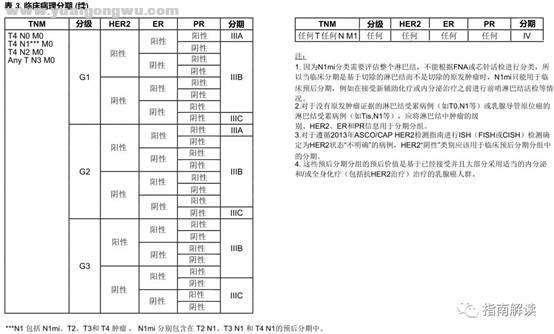
5 k5 \ ?4 V; v临床预后分期 F5 O+ A9 I7 Q6 m2 Z6 H# p% |
* L$ i1 Z' H% \
 * [- H6 Y, c' Q& s! O! h
* [- H6 Y, c' Q& s! O! h
& V* \" v3 G# E. T
 ) O& N2 @- A/ h" i/ g
) O& N2 @- A/ h" i/ g ) L( G) Y+ l) [9 O9 @; g
 # @5 o% w* B U2 ]7 U4 I
# @5 o% w* B U2 ]7 U4 I
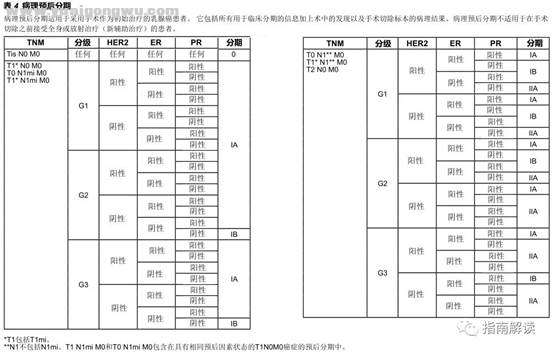
6 I" z1 _, R, |: A* HST-8,9,10, h5 j' A! C- {* N) S6 x
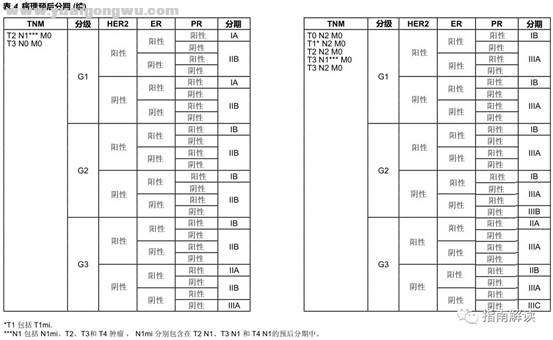
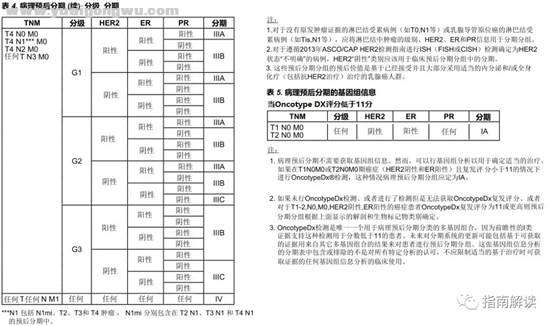
病理预后分期+ x( K( d: v# c g" I* N
; W* Q6 L) z# P3 f
 ) l, N+ z8 }! g9 \: ~2 a, R
) l, N+ z8 }! g9 \: ~2 a, R
/ L4 N5 |( b [; v8 s3 n
 - Z/ I& }1 T o1 ^$ H, ]" M r
- Z/ I& }1 T o1 ^$ H, ]" M r
& v# ?" P; M# _* J3 N7 r
 , y; F1 [3 U9 i& H: M1 z
, y; F1 [3 U9 i& H: M1 z ; ?2 j+ p* d# x
2 Q4 c+ B2 D' a7 N
|