马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?立即注册

x
作者:小山丘的旅行
针对性治疗
c-MET抑制剂
相比其他驱动突变(如EGFR、ALK等),MET基因异常存在更多的共突变情况,且多线治疗可能累积增加共突变的发生。这些共突变对后续治疗的影响提示我们,为更充分取得靶向获益,避免因多线治疗而失去机会,靶向治疗是一线的首选。
根据药物的结合位点,c-MET抑制剂可分为I型 Ⅱ型 Ⅲ型。

(1)Ia型MET抑制剂的代表:克唑替尼 PROFILE-1001试验,65名晚期NSCLC患者,MET-14跳跃突变,ORR=32%,中位PFS=7.3个月,中位OS估计为20.5个月。
(2)Ib型药物对MET的选择性高,脱靶效应较少(结合牢固)。在很多MET治疗的共识里,Ib型药物比Ia型药物的推荐级别更高。

Ib型MET抑制剂对MET-14跳跃突变的非小肺癌患者疗效
目前在开展的特泊替尼II期临床单臂试验,明确要求MET扩增患者。感兴趣的病友可以了解一下。2021年特泊替尼的国外价格,据说45800元/瓶。
(3)Ⅱ型的药物 ①目前来说,比较便宜好买的,可能是卡博替尼(XL184)。但XL184问题在于剂量与毒副反应的平衡。
XL184临床用于肺癌时的标准量是60mg,换算原料大概是76mg/天。这个剂量,国内患者不太好接受。剂量上去了,毒性反应大,不容易耐受。剂量不上去吧,又不太有效。
叶峰主任的直播讲课里,建议特别瘦的患者可以从40mg开始爬坡,一周后到60mg。体重大的可以60mg起始。这里讲的应该是正版药剂量。(个人觉得,这个量,也有点挑战) 。如果是联药用法,XL184的剂量可能要比单用剂量少一些,(正版40mg?也就是原料50mg。具体结合自身的副反应耐受情况,做下增减)。
②梅沙替尼,药物目前不容易买到,原料也贵(3.75g/月,费用近万)。部分意见认为,原料虽然有尝试成功的案例,但药型结构可能会影响疗效(正版药物是纳米缓释片,而肠溶胶囊型制剂的应用是失败的。这是否意味着,直接粉剂用法的原料不行?)。疑问归疑问,经济允许的话,梅沙替尼也是种不错的选择。期待上市。
(4)其他临床药物 国内开展的临床药物有伯瑞替尼、谷美替尼等。印象中,伯瑞替尼19年初就开始招募了,现在还没看到比较明确利好的消息。只能说,临床入组,给大家多一种选择吧。
耐药机制和对策
c-MET抑制剂的耐药机制,包括:原发共突变导致耐药,二次MET突变耐药,旁路激活耐药等。
ASCO 2020口头报道:对60495例NSCLC患者进行分析,共1387例(2.3%)携带MET-14跳跃突变。所有的MET-14跳跃突变患者中,32%合并MDM2 扩增;19%合并CDK4 扩增;12%存在MET扩增,3.2%合并KRAS突变,0.65%存在EGFR突变。其中,36例患者在耐药后进行二次检测,61%(22例)存在获得性改变。获得性耐药机制:25%获得性MET突变(D1228X、Y1230X、Y1003F、D1228A/E/H+L1195V),8%获得性MET扩增。其他如EGFR/ERBB2激活、KRAS扩增和PI3K突变等。[12]

(MET-14跳跃突变的潜在获得性耐药机制-文献12)
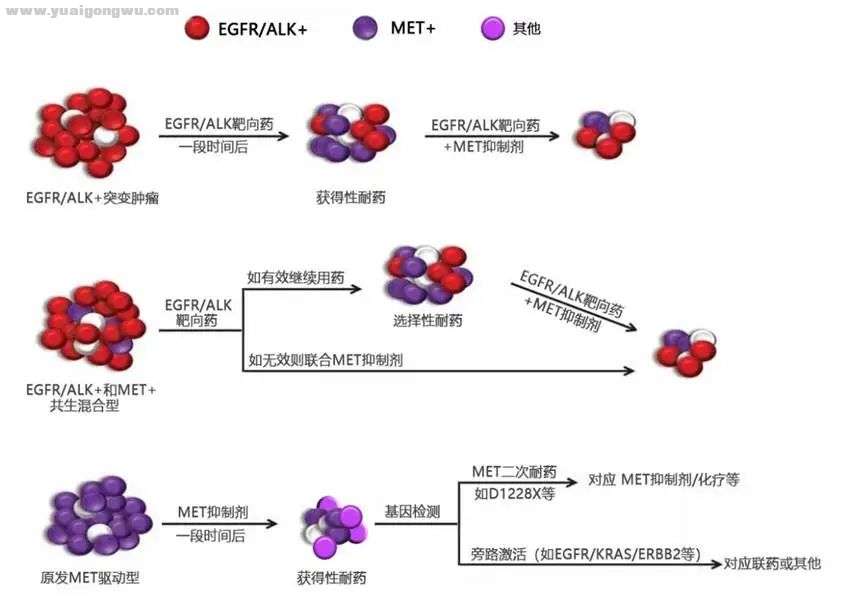
(1)原发共突变导致耐药 如存在原发共突变,是否联药应根据具体情况,如下图。
(2)MET二次突变导致的耐药 ①I型MET抑制剂耐药后Y1230C/D/S/H/N或D1228E/G/H/N是常见的耐药位点。原发MET突变在位点改变后出现该位点可能占比高达64%。
一些研究表明Ⅱ型卡博替尼、梅沙替尼能部分克服耐药,特别是出现Y1230和D1228X(D1228A/Y除外)。目前有一些个例有效的报道,但仍需要进一步的临床细化。
②II型药物耐药后,如出现MET二次耐药(位点改变),主要是L1195F/V及F1200I/L,其中F1200占二次耐药部分的72%,可以考虑Ib型药物。也可能出现其他的耐药突变,如HER-2扩增,KRAS突变等,需要针对性联合用药,或序惯化疗/免疫等。
(3)药物与抗肿瘤活性的IC50参考

图中各药物的IC50数值,这种数值当然是越低越好。IC50=50%抑制浓度,即凋亡细胞/全部细胞=50%时对应需要的血药浓度。
实际应用上,体内需要的血药浓度可能更高,也许是IC50值的10倍。而且会随着个体治疗的不同、时间的推移而出现变化。也许这能够解释不同研究者提供的IC50数据经常有出入的原因。
从临床效果看,IC50也不是完全跟疗效对应,参考意义大于指导意义。
免疫检查点抑制剂治疗ICIs
KEYNOTE-024、KEYNOTE-189和KEYNOTE-407,Checkmate 227,Checkmate 9LA等试验表明,免疫治疗有可能长期获益。
这些试验排除了EGFR/ALK突变的患者,但都没有排除MET异常患者。在一些研究报告中,MET-14跳跃突变患者的PD-L1表达相对较高,高表达率大概40-70%。如ASCO 2020口头报道:1387例MET-14跳跃突变NSCLC患者的PD-L1高表达比例高达48%。
这是否意味着,MET异常人群更能从免疫抑制剂治疗中获益呢?
①J.K.Sabari等人的回顾性研究,分析2014年1月-2017年5月共2869名非小细胞肺癌患者,其中147名存在MET-14跳跃突变。免疫疗效可评估的24名患者(22例单用免疫),ORR=17%,中位PFS=1.9m,中位PFS=18.2m,疗效很有限。[14]
②日本的一项回顾性研究:对2010-2019年确诊的1954例非小细胞肺癌患者进行分析,3.5%(68例)被检测到MET-14跳跃突变。其中,24例受检患者中,70.8%为PD-L1高表达。其中7例进行ICI单免疫疗法,客观有效率ORR=42.9%,PFS=24.7个月,长期疗效显著。[15]
③回顾分析了337例MET改变的IIIB/IV期NSCLC患者。MET扩增组:ICI免疫治疗OS=19.0m,优于化疗OS=8.0m。尤其是MET高度扩增患者,中位OS高达36m,优势明显。而MET-14跳跃突变患者组,ICI免疫治疗和化疗的中位OS没有显著差异。[13]

④回顾性研究IMMUNOTARGET:针对551例晚期非小细胞肺癌患者,亚组MET异常36例(23例MET-14跳跃+13例MET扩增),免疫单药ORR=16%,50%的患者疾病进展,36.4%的患者为快速进展(治疗2个月内进展),中位PFS为3.4个月,12个月PFS率为23.4%,中位OS为18.4个月。MET-14跳跃突变和MET扩增患者间的中位PFS无统计学差异。
从上述临床研究和报道,我们觉得,MET异常患者的免疫临床有限,整体的获益人群也有限(原发MET高度扩增患者可能获益)。但并不能说明MET-14跳跃或MET扩增患者不能考虑免疫。
如果有明确的靶向获益,肯定优先考虑靶向。但如果治疗方案不多、获益空间都不大的情况下,免疫还是应该对照考虑看看的。需要注意的是,靶向和免疫的联合或序贯可能带来的毒性影响。如免疫治疗后序贯克唑替尼,毒性反应可能增加。
Amivantamab(JNJ-372) EGFR/MET双靶单抗,目前FDA仅批准用于经治的EGFR 20ins突变。
CHRYSALIS研究:19例MET-14跳跃NSCLC患者(40%吸烟,42%曾接受过MET靶向治疗,68%曾化疗过,42%曾接受免疫治疗,21%初治),输液反应74%,多数1-2级,客观缓解率64%,中位客观缓解时间4.1月,中位持续治疗时间6.5个月。期待ing
ADC药物Teliso-v (Telisotuzumab Vedotin)
WCLC2021(Abstract 15.04)报道了该药物对晚期NSCLC MET阳性突变患者有一定的效果。2期试验NCT03539536,Teliso-V剂量为1.9 mg/kg Q2W,免疫组化(SP44抗体)集中检测c-MET状态,非鳞EGFR野生型ORR=35.1% (c-MET高表达组53.8%,c-MET中间组25.0%),但在鳞癌和EGFR突变组中疗效较低。
脑转移治疗
MET-14跳跃突变的非小细胞肺癌患者发病率高达20–40%,跟IV期NSCLC患者相似。免疫治疗和克唑替尼的疗效有限。卡马替尼(INC280)和特泊替尼被认为有较高的CNS活性,常被推荐用于有脑转移的MET-14跳跃突变患者。
GEOMETRY mono-1试验,可评估的13名MET-14跳跃突变的脑转移患者,7名对280有颅内反应(3名曾做过放疗)。其中4名完全缓解。
VISION试验,23名基线检查有脑转的患者,15名患者可通过RANO-BM标准评估反应。7名可测量疾病的患者,特泊替尼的颅内最佳总体反应BOR为71%(3名病灶完全消失)。此外,报告表明,对于有症状的肺腺癌脑转移MET的患者,特泊替尼的颅内反应更长久。
其他选择,如沃利替尼:ASCO2020单臂Ⅱ期研究NCT02897479,治疗593例NSCLC患者,87例具有MET-14外显子跳跃突变,70例接受沃利替尼Savolitinib治疗,肺肉瘤样癌PSC+占比35.7%,腺癌占57.1%,脑转移占比31.1%。排除PSC,41例可有效评估疗效的患者ORR=48.8%,DCR=95.1%,PFS=9.7个月
其他/案例报道
(1)一项卡马替尼(INC280)的研究,入组20名MET-14跳跃突变或MET扩增肺癌患者。
13名治疗耐药后进行血液分析,3名检出D1228或Y1230突变,1名检出BRAF扩增+D1228或Y1230突变,1名检出HER-2扩增,1名NF1扩增+RAF1扩增,1名KRAS突变,1名BRAF V600E突变。
说明,MET靶向后耐药的,仅部分可通过I型、II型MET-TKIs之间的切换实现应答。同时也说明,MET抑制剂治疗后的耐药因素多样,基因检测很有必要。
(2)原发MET-14跳跃突变
案例:肺腺癌Ⅳ期,原发MET-14跳跃突变。卡马替尼(INC280)用药(250mg,后调整为300mg bid)7个月后进展,选择培美曲塞+信迪利单抗维持1年,2021年1月开始换用Ⅱ型的梅沙替尼125mg qd,半年后耐药,换用Ⅰb型的卡马替尼(INC280),评估有效(来源:与癌共舞包大包帖)。
(3)EGFR-TKIs患者
案例①:特罗凯耐药后,测序存在MET扩增。采用特罗凯+I型的卡马替尼(INC280),有效18个月。进展后,基因检测存在MET D1228E二次突变。采用特罗凯+II型的卡博替尼(XL184)60mg(非原料),一个月评估有效,但副反应影响实在太大。卡博替尼(XL184)减量调整为45mg,总有效6个月。

案例②:EGFR-19del患者,易瑞沙16个月后进展。基因检测19Del+MET扩增,采用奥希替尼+沃利替尼治疗。19个月后再次进展,基因检测19Del+MET扩增+MET D1228N,采用奥希替尼+卡博替尼(XL184),SD评估稳定,但副反应严重,无奈停用。
(4)融合报道: 2017年,Davies等在JCO Precis Oncol上报道了首例非小细胞肺癌中MET融合治疗。该患者对克唑替尼有显著疗效。
2018年3月,Clin Cancer Res杂志上发表了MET结构改变的文章。对肺癌常见驱动基因突变阴性的患者进行NGS杂交测序,2名肺腺癌患者标本上观察到KIF5B-MET融合,STARD3NL-MET融合,并都对克唑替尼部分反应。
ASCO2018,中国2410例非小细胞肺癌标本,有1名肺腺癌患者存在MET-ATXN7L1融合,该患者对克唑替尼有部分反应。
2018 年,Zhu等在J Thorac Oncol上发表第1例肺腺癌患者因EGFR TKI耐药导致的MET-UBE2H融合,并在联合克唑替尼后得到持续的部分缓解。
参考文献 ⑴Lai GGY, Lim TH, Lim J, et al. Clonal MET Amplification as a Determinant of Tyrosine Kinase Inhibitor Resistance in Epidermal Growth Factor Receptor-Mutant Non-Small-Cell Lung Cancer. J Clin Oncol. 2019 Apr 10;37(11):876-884. ⑵Canadian Consensus Recommendations on the Management of MET-Altered NSCLC(2021) ⑶肺癌获得性MET D1228V突变及对MET抑制剂的耐药性: Cancer Discov. 2016 December ; 6(12): 1334–1341. doi:10.1158/2159-8290.CD-16-0686. ⑷Acquired MET Y1248H and D1246N Mutations Mediate Resistance to MET Inhibitors in Non–Small Cell Lung Cancer.Published OnlineFirst April 10, 2017; DOI: 10.1158/1078-0432.CCR-16-3273 ⑸Gillianne G.Y. Lai,et al.Clonal MET Amplification as a Determinant of Tyrosine Kinase Inhibitor Resistance in Epidermal Growth Factor Receptor–Mutant Non–Small-Cell Lung Cancer.Journal of Clinical Oncology.January 24, 2019: DOI https://doi. org/10.1200/JCO.18.00177 ⑹Camidge RD, Ou S-HI, Shapiro G, et al. Efficacy and safety of crizotinib in patients with advanced c-MET-amplified non-small cell lung cancer. J Clin Oncol 2014;32(Suppl 5):Abstract 8001. ⑺Wolf J, Seto T, Han JY, et al. Capmatinib in MET Exon 14-Mutated or MET-Amplified Non-Small-Cell Lung Cancer. N Engl J Med. 2020 Sep 3;383(10):944-957. doi: 10.1056/NEJMoa2002787. ⑻Paik PK, Felip E, Veillon R, et al. Tepotinib in Non-Small-Cell Lung Cancer with MET Exon 14 Skipping Mutations. N Engl J Med. 2020 Sep 3;383(10):931-943. doi: 10.1056/NEJMoa2004407. ⑼Recondo G, Bahcall M,et al. Molecular Mechanisms of Acquired Resistance to MET Tyrosine Kinase Inhibitors in Patients with MET Exon 14-Mutant NSCLC. Clin Cancer Res. 2020 Jun 1;26(11):2615-2625. doi: 10.1158/1078-0432.CCR-19-3608. Epub 2020 Feb 7. PMID: 32034073. ⑽OA15.04 - Telisotuzumab Vedotin (teliso-v) Monotherapy in Patients With Previously Treated c-Met+ Advanced Non-Small Cell Lung Cancer.2021 World Conference on Lung Cancer ⑾Robin Guo et al, MET-dependent solid tumours - molecular diagnosis and targeted therapy,Nat Rev Clin Oncol . 2020 Sep;17(9):569-587. ⑿Mark M. Awad, et al. Characterization of 1,387 NSCLCs with MET exon 14 (MET-14) skipping alterations (SA) and potential acquired resistance (AR) mechanisms. Presented at: 2020 ASCO Virtual Scientific Program; May 29, 2020. Abstract 9511. (13)Kron A, , et al. Genetic heterogeneity of MET-aberrant non-small cell lung cancer and its impact on the outcome of immunotherapy.J Thorac Oncol.2020. DOI:10.1016/j.jtho.2020.11.017 (14)Sabari JK, Leonardi GC, Shu CA, et al: PD-L1 expression, tumor mutational burden, and response to immunotherapy in patients with MET exon 14 altered lung cancers. Ann Oncol.2018 DOI: 10.1093/annonc/mdy334 (15)Yasuhiro Kato,et al.Long-term efficacy of immune checkpoint inhibitors in non-small cell lung cancer patients harboring MET exon 14 skipping mutations. Int J Clin Oncol.2021 DOI: 10.1007/s10147-021-01893-0 (16)Hang-Ping Yao et al, Progress and challenge in development of biotherapeutics targeting MET receptor for treatment of advanced cancer,Biochim Biophys Acta Rev Cancer . 2020 Dec;1874(2):188425. (17)Socinski, Mark A et al. “MET Exon 14 Skipping Mutations in Non-Small-Cell Lung Cancer: An Overview of Biology, Clinical Outcomes, and Testing Considerations.” JCO precision oncology vol. 5 PO.20.00516. 13 Apr. 2021, doi:10.1200/PO.20.00516
|